
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)

(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:

(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: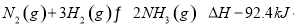 mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
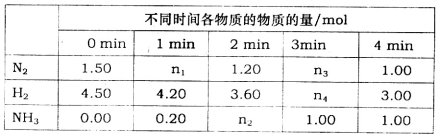
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
(17分)
⑴ -122.5 kJ·mol-1 (2分) ⑵ k3 =k1· k2 (2分)
⑶ ① CH3OCH3 - 12e- +3H2O = 2CO2+12H+ (2分) ② 14 (2分)
⑷ ① 0.05mol/(L·min) (2分)② 0.15 (2分) ③正向(1分) 不变(1分)
(5) 大于(1分) 0.05(2分)
【解析】
试题分析:(1)根据盖斯定律,将已知热化学方程式中的CO、CH3OH消去,可得所求热化学方程式,所以2CO2(g)+6H2(g)= CH3OCH3(g)+3 H2O(g)的△H=(-90.7kJ/mol)×2+(-23.5kJ/mol)-(-41.2kJ/mol)×2=-122.5kJ/mol;
(2)根据化学平衡常数的定义,K1=c(CO)2/c(CO2),K2= c(CO2) c(H2)/ c(CO) c(H2O),K3= c(CO) c(H2)/ c(H2O),所以K1 K2= K3;
(3)①二甲醚在负极发生氧化反应,电解质溶液为酸性溶液,所以失去电子生成二氧化碳和氢离子,电极反应式是CH3OCH3 -12e- +3H2O=2CO2+12H+;
②电解食盐水的化学方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑,生成2.24L氢气,物质的量是0.1mol,生成氯气的物质的量应是0.1mol,而溶液中氯离子的物质的量是0.1mol,所以最多生成刘强东物质的量是0.05mol,则产生的氢氧化钠的物质的量是0.1mol,氯离子放电完全后,电解的实质是电解水,所以氢氧根离子的浓度是0.1mol/0.1L=1mol/L,所以溶液的pH=14;
2NaOH+H2↑+Cl2↑,生成2.24L氢气,物质的量是0.1mol,生成氯气的物质的量应是0.1mol,而溶液中氯离子的物质的量是0.1mol,所以最多生成刘强东物质的量是0.05mol,则产生的氢氧化钠的物质的量是0.1mol,氯离子放电完全后,电解的实质是电解水,所以氢氧根离子的浓度是0.1mol/0.1L=1mol/L,所以溶液的pH=14;
(4)①0 min~1 min内氨气的物质的量增加0.2mol,则氮气的物质的量减少0.1mol,则N2的平均反应速率=0.1mol/2L/1min=0.05 mol/(L·min);
②该条件下平衡时各物质的浓度是:氨气1.00mol/2L=0.5mol/L,则氮气的浓度是1.5mol/2L-0.5mol/L/2=0.5mol/L,氢气的浓度是氮气的3倍,为1.5mol/L,则反应的平衡常数k=0.52/(0.5×1.53)=0.15;
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,相当于增大压强,平衡正向移动,因为温度不变,则平衡常数不变;
(5)0.2mol/L的HCOOH与0.1mol/L的NaOH溶液等体积混合,得到的溶液为0.05mol/L的HCOOH和HCOONa的溶液,因为溶液呈酸性,说明HCOOH的电离程度大于HCOO-的水解程度;根据物料守恒,则2 c(Na+)= c(HCOOH)+c(HCOO-)=0.1mol/L,根据电荷守恒,则c(Na+)+ c(H+)= c(OH-)+c(HCOO-),两式结合可得c(HCOOH)- c(OH-)+ c(H+)= c(OH-)+c(HCOO-)- c(H+)= c(Na+)=0.05mol/L。
考点:考查盖斯定律的应用,平衡常数的计算,溶液pH的计算,电化学反应原理的应用,离子浓度的比较


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:实验题
某同学设计如下实验验证炭与浓硫酸的反应产物及产物的某些性质。
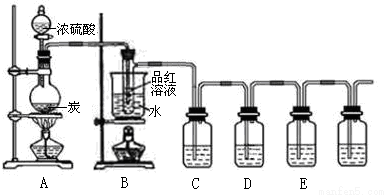
(1)装置A中盛放浓硫酸的仪器名称是 。
(2)若要证明有水生成,需要在A、B之间加装盛有 的干燥管。
(3)利用装置B可以完成的实验是 。
(4)若在E中盛装澄清石灰水,C中盛装酸性高锰酸钾溶液,则D中的试剂是 ,其作用是 ;写出C中关于高锰酸钾发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表:

据此,将甲和乙互相分离的最佳方法是
A.萃取 B.过滤 C.蒸馏 D.分液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:实验题
(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三1月月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
NO2、NH3和O2组成的混合气体,在一定条件下恰好完全反应,生成N2和H2O,则原混合气体中 NO2、NH3和O2的体积比可能是(不考虑NO2与N2O4之间的转化)
A.2:4:l B.2:1:2 C.1:l:1 D.1:4:3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.图1所示装置可制取氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.图3所示装置可制备Fe(OH)2并容易观察到白色沉淀
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂自性、还原性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是
A.海水中含有溴元素,需经过化学变化才可以得到溴单质
B.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三1月月考化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用均正确的是
A.工业上分别用电解氧化镁和氧化铝的方法制备镁和铝
B.铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水
C.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
D.用二氧化硫加工银耳,使之更白
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com