
I.如图为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/L CH
3COOH溶液过程中溶液pH的变化曲线.请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH
3COOH恰好完全反应,这种看法是否正确?
(选填“是”或“否”).
若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?
区间(若正确,此问不答).
(2)AB区间,c(OH
-)>c(H
+),则c(OH
-)与
c(CH3COO-)大小关系是
.
A.c(OH
-)大于
c(CH3COO-)B.c(OH
-)小于
c(CH3COO-)C.c(OH
-)等于
c(CH3COO-)D.上述三种情况都可以
(3)在D点时,溶液中
c(CH3COO-)+c(CH3COOH)
2c(Na
+)(填“>”“<”或“=”).
Ⅱ.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验.请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 |
NaOH溶液的浓度
(mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
| 1 |
0.10 |
22.02 |
20.00 |
| 2 |
0.10 |
22.00 |
20.00 |
| 3 |
0.10 |
21.98 |
20.00 |
(1)滴定达到终点的现象是
;此时锥形瓶内溶液的pH的范围是
.
(2)根据上述数据,可计算出该盐酸的浓度为
.
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有
(多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失.

 I.如图为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/L CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/L CH3COOH溶液过程中溶液pH的变化曲线.请回答:


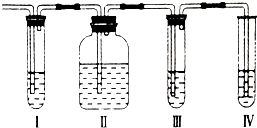 在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题: 铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用.
铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用. 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题: