
【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | ________ |
② | ________ | ________ | 1 | 0.5a |
③ | m | g(g=4m) | 0 | ________ |
【答案】>1.5a 0 0.5 am或者![]()
【解析】
恒温恒压下,对于N2+3H22NH3反应来说,欲保持平衡时各组分的体积分数不变,则应采用一边倒的方法,将产物全部转化为反应物,然后利用各反应物的物质的量之比等于化学计量数之比的原则,求各反应物的物质的量。
温度、压强一定时,当各生成物的物质的量为0,反应物的物质的量之比等于化学计量数之比时,达等效平衡状态。
①把物质的量改写为n(N2)=1.5mol,n(H2)=6mol,达平衡后,再加入3molH2。n(N2)=1.5mol,n(H2)=6mol时,与已知平衡体系等效,此时生成NH3的物质的量为1.5amol,再加入3molH2,平衡正向移动,NH3的物质的量增大,所以平衡时,n(NH3)>1.5amol。
②设起始时,n(N2)=x,n(H2)=y,将NH3全部转化为反应物,此时N2的物质的量为x+0.5mol,H2的物质的量为y+1.5mol,由于平衡时n(NH3)=0.5amol,为原平衡体系的0.5倍,所以采用一边倒后,各反应物的物质的量也为已知平衡体系中起始量的0.5倍,所以x+0.5=0.5,x=0;y+1.5=2,y=0.5;
③起始时,n(N2)=m,n(H2)= g(g=4m), n(NH3)=0,与题干中的平衡体系等效,所以达平衡时,n(NH3)为原平衡时的m倍或![]() 倍,所以n(NH3)= am或者
倍,所以n(NH3)= am或者![]() 。
。
答案为:>1.5a;0;0.5;am或者![]() 。
。


科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
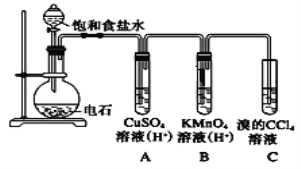
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________________
(2)用饱和食盐水代替蒸馏水的目的是__________________
(3)装置A的作用是_______________,装置B中的现象是__________________
(4)如果要进行乙炔的可燃性实验,首先应该__________________。
(5)若乙炔加氢后得到乙烷,则乙烷在光照条件下与氯气反应,生成的一氯代烷最多有__________种。
(6)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为___________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是3种物质的溶解度![]() ,下列说法中正确的是
,下列说法中正确的是![]()
物质 |
|
|
|
溶解度 | 74 |
|
|
A.已知![]() 的
的![]()
![]() ,则所有含有固体
,则所有含有固体![]() 的溶液中,都有
的溶液中,都有![]() ,且
,且![]()
![]()
B.除去粗盐中含有的![]() 杂质,最佳除杂试剂为
杂质,最佳除杂试剂为![]() 溶液
溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有![]() 和
和![]() 的硬水,发生的离子反应方程式为
的硬水,发生的离子反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。

下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
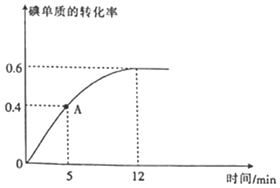
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用pH传感器来测定![]() 和
和![]() 混合物中
混合物中![]() 的含量,称取
的含量,称取![]() 样品,溶于水配成
样品,溶于水配成![]() 溶液,取出该溶液
溶液,取出该溶液![]() 用
用![]() 盐酸滴定,得到图曲线.下列说法不正确的是
盐酸滴定,得到图曲线.下列说法不正确的是![]()
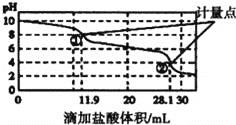
A.此样品![]()
B.计量点![]() 溶液中大量存在的阴离子是
溶液中大量存在的阴离子是![]()
C.计量点![]() 之间发生反应的离子方程式为
之间发生反应的离子方程式为![]()
D.使用该方法测定![]() 和NaOH混合溶液中的NaOH含量,将会得到1个计量点
和NaOH混合溶液中的NaOH含量,将会得到1个计量点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 个
个![]() 胶体粒子的质量为78g
胶体粒子的质量为78g
B.![]() g
g![]() 和CuO的混合物中含有铜原子数为
和CuO的混合物中含有铜原子数为![]()
C.在![]() 的碳酸钠溶液中,阴离子总数一定大于
的碳酸钠溶液中,阴离子总数一定大于![]()
D.标准状况下,![]() L己烷中共价键数目为
L己烷中共价键数目为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com