
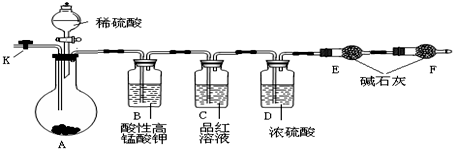
分析 根据实验目的,结合实验装置原理可以判断:A为发生装置,反应后生成二氧化碳和二氧化硫气体及少量的水蒸气杂质,为了准确测定生成CO2气体的质量,首先要除尽SO2,因此B中应装入酸性高锰酸钾溶液,C装置用来检验SO2气体是否被完全吸收,可以选用品红溶液,在吸收二氧化碳之前,要再除去杂质水蒸气,因此D中应装入浓硫酸,为了吸收二氧化碳,E装置应装入碱石灰,为了防止空气中的水蒸气、二氧化碳等杂质进入E,应在F中加入碱石灰起保护作用,为了能使反应后装置中的二氧化碳完全被碱石灰吸收,反应结束后在装置中通入氮气,用氮气将二氧化碳压到碱石灰中,据此答题.
解答 解:根据实验目的,结合实验装置原理可以判断:A为发生装置,反应后生成二氧化碳和二氧化硫气体及少量的水蒸气杂质,为了准确测定生成CO2气体的质量,首先要除尽SO2,因此B中应装入酸性高锰酸钾溶液,C装置用来检验SO2气体是否被完全吸收,可以选用品红溶液,在吸收二氧化碳之前,要再除去杂质水蒸气,因此D中应装入浓硫酸,为了吸收二氧化碳,E装置应装入碱石灰,为了防止空气中的水蒸气、二氧化碳等杂质进入E,应在F中加入碱石灰起保护作用,为了能使反应后装置中的二氧化碳完全被碱石灰吸收,反应结束后在装置中通入氮气,用氮气将二氧化碳压到碱石灰中,
(1)将仪器连接好以后,必须进行的第一步操作是检验装置的气密性,
故答案为:检验装置的气密性;
(2)根据上面的分析可知,装置B的作用是 吸收二氧化硫;装置D的作用 吸收水蒸气,
故答案为:吸收二氧化硫;吸收水蒸气;
(3)根据上面的分析可知,通入大量的氮气,这样做的目的是 使生成的二氧化碳气体能够被装置E中的药品完全吸收,否则由于二氧化碳没有完全被吸收,而使得计算出的Na2CO3含量的测定值比实际值 偏低,
故答案为:使生成的二氧化碳气体能够被装置E中的药品完全吸收;偏低;
(4)Na2CO3与Na2SO3混合物23.2g进行实验,实验结束后,发现E装置增重了4.4g,即反应中生成了二氧化碳的质量为4.4g,根据关系式Na2CO3~CO2可知,Na2CO3的质量为10.6g,所以Na2CO3含量为$\frac{10.6g}{23.2g}$×100%=45.7%,
故答案为:45.7%;
(5)实验过程中硫酸要加入过量的原因是让样品与硫酸充分反应,不影响反应的测定结果,
故答案为:让样品与硫酸充分反应,不影响反应的测定结果;
(6)装置B中二氧化硫被高锰酸钾氧化成硫酸根离子,所以反应的离子方程式为2MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+,
故答案为:2MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+.
点评 本题考查了测定Na2CO3与Na2SO3混合物中各组分的含量,题目难度中等,理解实验原理是解题的关键,试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA | |
| B. | 常温常压下,7.8 g苯中含有双键的数目为0.3 NA | |
| C. | 苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA | |
| D. | 标准状况下,22.4 L甲苯中含C-H键数目为8 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 10:1 | C. | 9:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钻木取火 | |
| B. | 青铜器生锈 | |
| C. | 焰色反应检验Na+ | |
| D. | 2015年9月3日,中国在抗日战争暨世界反法西斯战争胜利70周年之际,燃放烟花爆竹,举国欢庆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Na2O2→NaOH | D. | Na2CO3→NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3+KOH═KNO3+H2O | B. | 2HCl+Cu(OH)2═CuCl2+2H2O | ||
| C. | CH3COOH+NaOH═CH3COONa+H2O | D. | HCl+NH3•H2O═NH4Cl+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com