
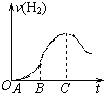
| A. | 负极反应:H2-2e-═2 H+ | |
| B. | 通O2的一极是发生还原反应 | |
| C. | 工作一段时间后电解质溶液的c(OH-)增大 | |
| D. | 工作时负极区附近pH增大 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,据此分析.
解答 解:A、在燃料电池中,通入燃料氢气的一极为电池的负极,在KOH溶液为电解质溶液时负极反应:H2-2e-+2OH-=2H2O,故A错误;
B、在燃料电池中,通通入O2的一极是正极发生还原反应,故B正确;
C、电池总反应即氢气在氧气中燃烧生成水,所以工作一段时间后电解质溶液的c(OH-)减小,故C错误;
D、氢氧燃料电池中通入氢气的一极为电池的负极,发生氧化反应,电极反应为:H2-2e-+2OH-=2H2O,负极区附近pH减小,故D错误.
故选B.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 液氯、晶体硅、臭氧均属于单质 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | CuO、MgO、Na2O2均属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
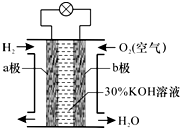 氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )
氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )| A. | a极为负极,b极为正极 | |
| B. | 负极发生氧化反应 | |
| C. | 正极的电极反应为O2+2H2O+2e-═4OH- | |
| D. | 负极的电极反应为H2+2OH--2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
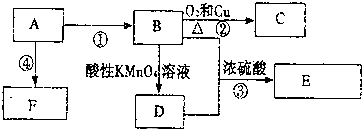
 ,F的结构简式
,F的结构简式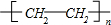 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com