
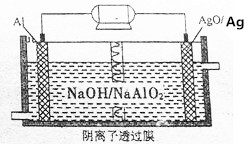
 我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )| A. | Al电极是该电池的正极 | |
| B. | Ag在AgO/Ag电极上发生氧化反应 | |
| C. | 该电池负极反应是2Al-6e-+8OH-═2AlO2-+4H2O | |
| D. | AgO/Ag电极溶液中的pH减小 |
分析 Al比Ag活泼,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,AgO被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,结合电极反应式进行判断.
解答 解:A.由原电池装置图可知铝被氧化生成NaAlO2,则Al为负极,故A错误;
B.AgO被还原,应为原电池的正极,故B错误;
C.Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,或2Al-6e-+8OH-═2AlO2-+4H2O,故C正确;
D.正极发生AgO+2e-+H2O=Ag+2OH-,pH增大,故D错误.
故选C.
点评 本题考查化学电源新型电池,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.


科目:高中化学 来源: 题型:解答题
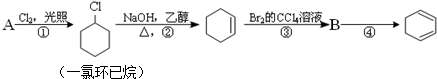
 ,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是
,①的反应类型是取代反应,③的反应类型是加成反应.反应④的化学方程式是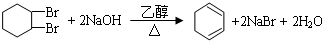
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
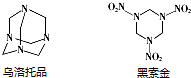 黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )
黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )| A. | 1:3 | B. | 1:4 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯主要是从石油分馏中获得的一种重要化工原料 | |
| B. | 甲烷和苯都能使酸性高锰酸钾溶液褪色 | |
| C. | 石油和煤均属于化石燃料,所含元素种类不相同 | |
| D. | C3H8有两种同分异构体,C5H12有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的比例模型  | B. | 溴乙烷的电子式: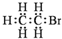 | ||
| C. | 2-氯丙烷的结构简式:CH3CHClCH3 | D. | 丙烯的键线式: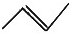 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 实验结论 | |
| A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-,SO32-,HSO3-中的一种或几种 |
| B | 将纯碱和硫酸反应生成的气体,通入一定浓度Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 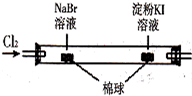 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| D | 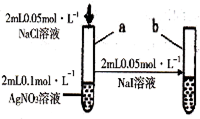 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com