
【题目】“84 消毒液”能有效杀灭甲型 H1N1 病毒,某同学购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。查阅相关资料和消毒液包装说明得到 如下信息:
① ②NaClO = Na++ClO-
②NaClO = Na++ClO-
(1)该“84 消毒液”的物质的量浓度约为_____(保留 1 位小数)。
(2)某同学取 100mL 该“84 消毒液”,按要求稀释后用于消毒,稀释后的溶液中c(Na+)=_____mol·L1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 480mL 含 NaClO 质量分数为25%的消毒液。下列说法不正确的是____________(填字母)。
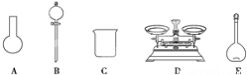
A.如下图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶
C.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 149.0g
(4)该同学对容量瓶及其使用方法的认识中正确的是_____(填字母)。
A.容量瓶上标有容积、温度和浓度 B.使用前要检查容量瓶是否漏液 C.容量瓶用蒸馏水洗净后,须烘干后再使用 D.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
(5)一瓶上述“威露士”牌“84 消毒液”能吸收空气中_____L 的 CO2(标准状况)而变质。(已 知:CO2+NaClO+H2O=NaHCO3+HClO)
(6)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4 mol·L-1 的浓 硫酸配制 500 mL2.3 molL﹣1 的稀硫酸用于增强“84 消毒液”的消毒能力,需取用浓硫酸的体 积为______________mL。
(7)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____(填代号)。
①用量筒量取 98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的 H2SO4 溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
(8)现有密度为 d g/mL 浓度为 18 mol/L 的浓硫酸溶液 100 g ,需要加入一定量的水将其 稀释为浓度是 9 mol/L,则加入水的体积是_____(填字母)
A.大于 100 mL B.小于 l00 mL C.等于 100 mL
【答案】4.0 molL-1 0.04 AB B 89.6 62.5 ②③ B
【解析】
(1)根据c=![]() 进行计算;
进行计算;
(2)根据稀释规律进行计算;
(3)根据配制一定物质的量浓度的溶液操作步骤进行分析;
(4)根据容量瓶的结构和用途及配制过程的注意事项进行分析;
(5)根据,n(CO2)=n(NaClO),及V=nVm进行计算;
(6)根据溶液稀释前后溶质的量不变进行分析;
(7)根据c=![]() 进行分析;
进行分析;
(8)硫酸浓度越大,密度越大,结合溶液在稀释前后溶质的量不变进行计算。
(1)根据c=![]() =
=![]() =4.0 molL-1;
=4.0 molL-1;
故答案是:4.0 molL-1;
(2)将该消毒液稀释 100 倍(体积比)使用,稀释后的溶液中c(Na+)=4.0 molL-1×![]() =0.04 mol·L1;
=0.04 mol·L1;
故答案是:0.04;
(3)A.需要用托盘天平称量次氯酸钠固体,用烧杯来溶解固体,用玻璃棒进行搅拌和引流,用容量瓶和胶头滴管来定容,图示的AB不需用,还需要使用玻璃棒、胶头滴管,故A错误;
B.将称量好的 NaClO 固体在烧杯中溶解后,冷却到室温后,转移入容量瓶,故B错误;
C.定容时俯视容量刻度线,造成溶液的体积偏小,会导致所配溶液浓度偏高,故C正确;
D.配制 480mL 含 NaClO 质量分数为25%的消毒液,需要用500 mL容量瓶;需要称量 NaClO 固体的质量为 0.5L×4.0 molL-1×74.5g/mol=149.0g,故D正确;
故答案选AB;
(4)A.容量瓶上标有容积、温度和唯一刻度线,没有标注浓度,故A错误;
B. 容量瓶口部有活塞,使用前要检查是否漏液,故B正确;
C. 配制过程中需要加水,所以经蒸馏水洗净的容量瓶不必烘干后再使用,故C错误;
D.配制过程中,在定容之前需要初步摇匀,定容后还需摇匀,故D错误;
故答案选B。
(5)根据CO2+NaClO+H2O=NaHCO3+HClO反应可知,n(CO2)=n(NaClO)=1L×4.0 molL-1=4mol;标准状况下CO2的体积为:22.4L/mol×4 mol= 89.6L;
故答案是89.6;
(6)根据溶液稀释规律可知:18.4 mol·L-1×VmL=500 mL×2.3 molL﹣1,V=62.5;
故答案是:62.5;
(7)①用量筒量取 98%的硫酸时俯视,导致浓硫酸的量偏小,所配溶液的浓度偏低;不选;
②洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,含有溶质的物质的量偏大,溶液浓度偏高,故选;
③未等稀释后的 H2SO4 溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
④转移前,容量瓶中含有少量蒸馏水,对溶液体积和溶质的物质的量都不会产生影响,溶液浓度不变,故不选;
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液的体积偏大,溶液浓度偏低,故不选;
⑦定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
结合以上分析可知,只有②③符合题意;
故答案选②③;
(8)稀释前后溶质的量不变,则18mol/L×![]() =9mol/L×V(稀硫酸),解得V(稀硫酸)=
=9mol/L×V(稀硫酸),解得V(稀硫酸)=![]() mL,加入水的质量为ρ(稀硫酸)V(稀硫酸)-100g=
mL,加入水的质量为ρ(稀硫酸)V(稀硫酸)-100g=![]() -100g,由于硫酸的浓度越大,密度越大,则ρ(稀硫酸)<d,故加入水的质量小于100g,又因为水的密度为1g/cm3,所以加水的体积小于l00 mL,故B正确;
-100g,由于硫酸的浓度越大,密度越大,则ρ(稀硫酸)<d,故加入水的质量小于100g,又因为水的密度为1g/cm3,所以加水的体积小于l00 mL,故B正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在室温下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复室温后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
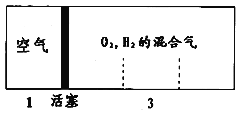
A.5:2B.4:5C.4:7D.2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求填写下列空白。
(1) ![]() 按官能团的不同分类,有机物类型为________类。
按官能团的不同分类,有机物类型为________类。
(2)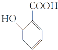 中官能团的名称是________________。
中官能团的名称是________________。
(3)键线式![]() 表示的有机物的结构简式是____________。
表示的有机物的结构简式是____________。
(4)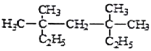 系统命名法为_________________。
系统命名法为_________________。
系统命名法命名有机物时应注意的问题_______ 、 _______(至少写两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图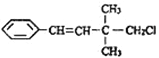 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列基团(或官能团)的名称或结构简式:
﹣CH2CH3_______、﹣Br_______、碳碳三键 _______
(2)乙烯的空间构型 _______
(3)乙炔的电子式_______
(4)苯的同系物的通式_______
(5)![]() 分子式:_______
分子式:_______
(6)![]() 其苯环上的一氯代物有_______ 种
其苯环上的一氯代物有_______ 种
(7)2,5﹣二甲基﹣4﹣乙基庚烷(写出结构简式) _______
(8)4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) _______
(9)![]() 的系统命名是_______
的系统命名是_______
(10) 1mol该物质消耗_______molH2,_______molBr2 _______molNa
1mol该物质消耗_______molH2,_______molBr2 _______molNa
(11)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_____;
(12)写出C5H8属于炔烃的所有同分异构体__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的资源宝库,除了可以得到氯化钠还可以从海带中提取碘。碘是人 体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定 量的 KIO3 进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其 检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)氧化产物与还原产物的物质的量比是_____;如果反应生成 0.3mol 的单质碘,则转 移的电子数目是_____。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和 KI 溶液,最后加入一定量的 CCl4, 振荡,这时候,观察到的现象是_____。
(3)若采用下图实验装置将四氯化碳和 I2 的混合溶液分离。
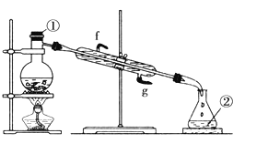
该装置还缺少的仪器是_______;冷凝管的进水口是:_______ (填 g 或 f)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,甲容器中充入N2和CO的混合气体,乙容器中充入O2,当它们的温度和密度都相同时,下列说法中正确的是
A.两容器中气体的压强相等
B.甲容器中气体的平均摩尔质量与乙容器中气体的摩尔质量相等
C.甲乙两容器气体的质量相等
D.甲乙两容器气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成如下,下列说法错误的是

A. Y的分子式为![]()
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能与5mol![]() 发生加成反应
发生加成反应
D. 等物质的量的X、Y分别与![]() 溶液反应,最多消耗
溶液反应,最多消耗![]() 的物质的量之比为1:1
的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com