
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2 。在含3 mol NaHSO3的溶液中逐滴加入KIO3
 溶液。加入KIO3和析出I2的物质的量的关系曲线如下图
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图
所示。下列说法不正确的是
A.0~b间反应:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b~c间反应:I2仅是氧化产物
D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的
KIO3 为1.08mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为了除去CO2气体中的SO2气体,下列对于仪器和药品的组合中合理的是( )
仪器:①洗气瓶,②干燥管;
药品:③固态生石灰,④苏打溶液,⑤小苏打溶液
A.①⑤ B.②⑤
C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是
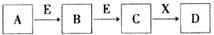 A.若D是一种白色沉淀,在空气中最终变为
A.若D是一种白色沉淀,在空气中最终变为
红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程所用仪器,且使用先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④电子天平 ⑤100 mL容量瓶
⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数
占核外电子总数的3/4,W—、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周
期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)Z在元素周期表中的位置 ,工业上生产Z单质的化学方程式为
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH
均大于7,组成元素的原子数目比均为1∶1∶1。若A能抑制水的电离,而B能促进水的电
离,则A、B的化学式分别为 、 。
(3)C是由上述四种元素的两种组成的相对分子质量为34的化合物,则C的电子式 。
(4)用B在碱性条件下可以处理CN—的工业废水,请将下列6种微粒:CN—、CO32—
N2、OH—、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式: + + ═ + + + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,
③2FeCl3+2KI==2FeCl2+2KCl+I2,④2FeCl2+Cl2==2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是 ( )
A. ClO3->BrO3->Cl2>Fe3+>I2 B. BrO3->Cl2>ClO3->I2>Fe3+
C. BrO3->ClO3->Cl2>Fe3+>I2 D. BrO3->ClO3->Fe3+>Cl2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是
A. m=4 R2+是还原剂 B. m=y R3+是氧化产物
C. m=2 R2+是氧化剂 D. m=y R3+是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基磷灰石是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:在剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:

(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O===Ca5(PO4)3OH↓+____ _ ___+___ _____。
②5Ca(OH)2+3H3PO4===__________________ ____________。
(2)与方法A相比,方法B的优点是___________ ____________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_______________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com