
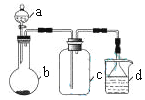
【题目】某化学探究学习小组拟利用如图所示装置(部分固定装置已略去)测定某黑色铜硫化物样品的化学式,按照如下步骤进行了实验。
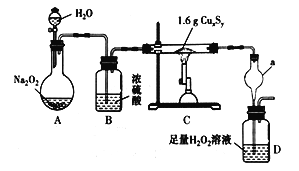
步骤一:利用右图所示装置,高温灼烧1.6gCuxSy至固体质量不再变化,得到红色固体和一种能使品红 溶液褪色的气体。
步骤二:将D中所得溶液按下述流程进行处理。
煮沸D中溶液并冷却→配制250mL溶液→取25.00mL溶液,滴入2-3滴酚酞溶液→滴定,消耗0.1 molL-1NaOH溶液20.00mL。
请回答下列问题:
(1)A装置中发生反应的化学方程式为_______________________。停止加热后还需继续通入一段时间的O2,其目的是________________________。
(2)仪器a的作用为________________。装置D中反应的化学方程式为__________________________。
(3)步骤二中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________;判断滴定终点的现象是____________________________。
(4)利用题中提供的数据可计算得出该铜硫化物的化学式为_______________。
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案(填“合理”或“不合理”),原因是____________________________。
【答案】 2Na2O2+2H2O=4NaOH+O2↑ 使生成的SO2全部被H2O2溶液吸收 防止倒吸 SO2+H2O2=H2SO4 250mL容量瓶、胶头滴管 当加入最后一滴NaOH溶液时,溶液变为浅红色且30秒内不褪色 Cu2S 不合理,部分SO2被氧化,且空气中的CO2和水蒸气可能使干燥管增重
【解析】本题考查实验方案设计与评价,(1)装置A中发生2Na2O2+2H2O=4NaOH+O2↑,根据操作步骤需要测SO2的含量,求铜硫化合物中硫的量,因此必须让SO2全部被吸收,反应停止后,继续通一段时间的O2,其目的是让SO2全部被吸收;(2)仪器a是干燥管,目的是防止倒吸;装置D中盛放的是H2O2,能把SO2氧化,化学反应方程式为H2O2+SO2=H2SO4;(3)配制溶液时,用到的玻璃仪器是玻璃棒、烧杯、胶头滴管、250mL容量瓶,缺少的是胶头滴管、250mL容量瓶;判断滴定到终点的标志是加入最后一滴NaOH溶液时,溶液变为浅红色且30秒内不褪色;(4)样品中硫的物质的量为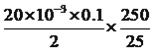 mol=0.01mol,样品中铜的物质的量为(1.6-0.01×32)/64mol=0.02mol,因此铜硫化合物的化学式为Cu2S;(5)装置D不能改用足量的碱石灰,因为空气中含有CO2和水蒸气,能被碱石灰吸收,造成所测S的物质的量偏大,因此此方案不合理。
mol=0.01mol,样品中铜的物质的量为(1.6-0.01×32)/64mol=0.02mol,因此铜硫化合物的化学式为Cu2S;(5)装置D不能改用足量的碱石灰,因为空气中含有CO2和水蒸气,能被碱石灰吸收,造成所测S的物质的量偏大,因此此方案不合理。


科目:高中化学 来源: 题型:
【题目】已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“鎶”;②合理利用核能符合“低碳经济”的要求,![]() 是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
A. ![]() 的原子核内中子数与核外电子数之差为55
的原子核内中子数与核外电子数之差为55
B. ![]() 和
和![]() 是同位素,核反应属于化学变化
是同位素,核反应属于化学变化
C. 40Ca2+与18O22-具有相同的电子数
D. Si2O64-中质子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.浓硫酸有氧化性,稀硫酸没有氧化性
B.可以用无锈铁丝代替铂丝进行焰色反应
C.氯水应保存在棕色细口试剂瓶中
D.硫酸铜溶液和氢氧化铁胶体都属于分散系,后者能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是
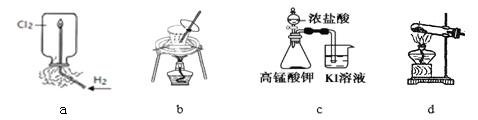
A. 用图a所示装置验证H2在Cl2中燃烧的实验现象
B. 用图b所示装置从饱和食盐水中提取氯化钠
C. 用图c所示装置探究氧化性:KMnO4>Cl2>I2
D. 用图d所示装置分解MgCl2·6H2O获取MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示:盐碱地产生碱性的原因:__________________________________________;
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n (填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是
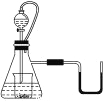
A. 过氧化钠 B. 氧化钠
C. 钠 D. 钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)![]() 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | |
② | 增大A的浓度 | |
③ | 使用催化剂 | |
④ | 恒容下冲入Ne(不参与体系反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2 ![]() HCOONa+H2O下列有关说法正确的是( )
HCOONa+H2O下列有关说法正确的是( )
A. 储氢、释氢过程均无能量变化
B. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
C. 上述储氢原理和钢瓶储氢原理相同
D. 1mol固体NaHCO3 中含有2NA个离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com