
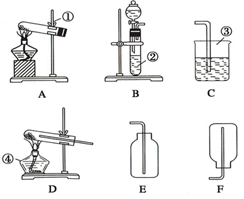
 现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)
现有A,B,C,D,E,F六种装置,如图所示.(胶塞,导管可自由选用)分析 (1)根据仪器的图形、构造判断仪器的名称;
(2)实验室可用加热高锰酸钾固体制备氧气,用稀硫酸和锌反应制备氢气,氢气密度比空气小,可用向下排空法收集氢气;
(3)B装置的仪器有分液漏斗、导管、试管等;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止铜被氧化.
解答 解:(1)由仪器的图形、构造判断①~④的仪器名称分别为铁架台、试管、烧杯、酒精灯;
故答案为:铁架台;试管;烧杯;酒精灯;
(2)实验室可用加热高锰酸钾固体制备氧气,氧气密度比空气大,可用向上排空法收集,则选用A、E装置,用稀硫酸和锌反应制备氢气,氢气密度比空气小,可用向下排空法收集氢气,则选用B、F装置;
故答案为:A;E;B;F;
(3)由图可知,B装置中用到分液漏斗;
故答案为:分液漏斗;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,可用B、D装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止铜被氧化.
故答案为:B;D;加热;通氢气;防止铜被氧化.
点评 本题主要考查物质的制备以及性质检验,为高频考点,侧重于学生的分析、实验能力的考查,要想解答好这类题目,就要熟记常用气体的发生装置和收集装置与选取方法及其依据,还有氧气、氢气的实验室制取方法,有时还需弄清图示信息等等,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
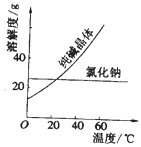
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于摩尔的说法中,正确的
A.是表示物质数量的单位 B.是表示物质质量的单位
C.是表示物质中所含的微粒数 D.是表示物质的量的单位
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
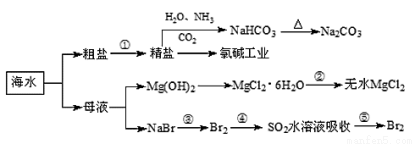
下列有关说法正确的是( )
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液的pH相比较(相同温度下)( )
A.前者大 B.相等 C.后者大 D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.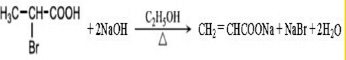 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
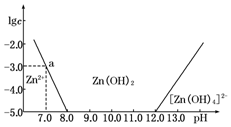
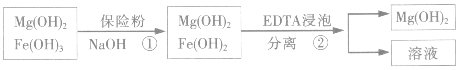
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com