
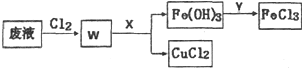
 ͭ���仯�����ڹ�ũҵ���������Ź㷺����;��
ͭ���仯�����ڹ�ũҵ���������Ź㷺����;������ ��1��Cu2S��Cu2O�ڸ����·�Ӧ����Cu��ͬʱ�����ڳ�����Ϊ�����һ�ֻ��������Ԫ���غ������
��2��Cu������������Ӧ������Cu2O���ӷ���������õ���ɫ��Һ���Դ˼���
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�����������Yת��Ϊ�Ȼ������ظ����ã�YΪ���
�ڸ���ͭ����Ũ�ȼ�����Һ�����pHֵ������Һ��������Ũ��Ϊ10-5mol/Lʱ������ȫ����Һ����СpHֵ���ݴ˸����ܶȻ�������Һ��������Ũ�ȣ�����������ҺpHֵ��
��� �⣺��1���١��ڷ�Ӧ�к�ͭ������Cu2S��Cu2O�ڸ����·�Ӧ����Cu��ͬʱ�����ڳ�����Ϊ�����һ�ֻ������Ԫ���غ��֪�������˶����������壬��Ӧ�ķ���ʽΪ��2Cu2O+Cu2S$\frac{\underline{\;����\;}}{\;}$6Cu+SO2����
�ʴ�Ϊ��2Cu2O+Cu2S$\frac{\underline{\;����\;}}{\;}$6Cu+SO2����
��2��Ϊ��֤��Ӧ�۵Ĺ�������Ƿ�Cu2O�������÷�����������飬�䷴Ӧ�����ӷ���ʽΪCu2O+2H+�TCu+Cu2++H2O����Cu������������Ӧ����ϡ�����ϡ�������õ���ɫ��Һ����֤����Cu2O����������ϡ���ᡢŨ���������ǿ�����ԣ���Cu��Ӧ�����ܼ��飻
�ʴ�Ϊ��CD��Cu2O+2H+�TCu+Cu2++H2O��
��3����W�к���CuCl2��FeCl3������Xʹ������ת��Ϊ�������������������X���ڵ�����ҺpHֵ���Ҳ��������ʣ�XΪCuO�ȣ�
�ʴ�Ϊ��CuO��
��ͭ���ӿ�ʼ����ʱ����Һ��c��OH-��=$\sqrt{\frac{Ks��������ͭ��}{c��C{u}^{2+}��}}$=$\sqrt{\frac{2��1{0}^{-20}}{0.5}}$=2��10-10mol/L��c��H+��=$\frac{1{0}^{-14}}{2��1{0}^{-10}}$=5��10-5mol/L������Һ�����pH=-lg5��10-5=4.3��������Ũ�ȿ�ʼ����ʱ����Һ��c��OH-��=$\root{3}{\frac{Ksp������������}{c��F{e}^{3+}��}}$=$\root{3}{\frac{1.0��1{0}^{-38}}{1{0}^{-5}}}$=10-11mol/L��c��H+��=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L������Һ����СpH=-lg10-3=3.0������ҺpHӦ������3.0��4.3֮�䣬
�ʴ�Ϊ��3.0��4.3��
���� ���⿼��������ԭ��Ӧ�������������������ơ������ƶϡ��ܶȻ����йؼ���ȣ���Ŀ�Ѷ��еȣ������ڿ���ѧ���Ի���֪ʶ��Ӧ�������������ͼ���������ע������ܶȻ������ڼ����е�Ӧ�ã�


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 X��Y��Z��R��W��Ϊ���ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������X2-��Y+����ͬ�ĺ�������Ų���Z���⻯��ķе������һ����ͬ��Ԫ���⻯��ķе�ͣ�R�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������ࣻWΪ����Ԫ�أ�X��W�γɵ�ij�ֻ�������Z���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡZ����̬���ʣ��ش��������⣨��ػش����Ԫ�ط��ű�ʾ����
X��Y��Z��R��W��Ϊ���ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������X2-��Y+����ͬ�ĺ�������Ų���Z���⻯��ķе������һ����ͬ��Ԫ���⻯��ķе�ͣ�R�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������ࣻWΪ����Ԫ�أ�X��W�γɵ�ij�ֻ�������Z���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡZ����̬���ʣ��ش��������⣨��ػش����Ԫ�ط��ű�ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ�2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-�� | |
| B�� | 0.1mol/L pHΪ4��NaHB��Һ�У�c��HB-����c��H2B����c��B2-�� | |
| C�� | ��ˮ�У�c��Cl-����c��H+����c��OH-����c��ClO-�� | |
| D�� | pH=3�Ĵ�����Һ��pH=11������������Һ�������Ϻ�pH=7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.48L | B�� | 5.6L | C�� | 6.72L | D�� | 8.96L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.6g�������ͳ�����ɵĻ�����к�����ԭ��������ĿΪ0.1NA | |
| B�� | 1molFeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA | |
| C�� | 1mol Na2O2�����к���������Ϊ4 NA | |
| D�� | �ڹ���������ˮ�ķ�Ӧ�У�ÿ����0.1mol������ת�Ƶ��ӵ���ĿΪ0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | �� | �� |
| A | ����� | Ũ���ᡢʯ��ʯ����ˮ�Ȼ��� |
| B | ����� | �����ᡢ����ˮ |
| C | ���������� | ������̼������������������ |
| D | ���������� | ���������������ơ������� |
| A�� | A�� | B�� | B�� | C�� | C�� | D�� | D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��1014����Һ��Ca2+��Na+��ClO-��NO3- | |
| B�� | 1.0mol•L-1��KNO3��Һ��H+��Fe2+��Cl-��SO42- | |
| C�� | ����0.1mo•L-1��Ca2+��Һ��Na+��K+��CO32-��Cl- | |
| D�� | ����������Һ�У�Na+��K+��MnO4-��AlO2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �赥�ʼȲ������ᷴӦ�ֲ�����Ӧ | |
| B�� | �������ÿ����ԭ���������ĸ���ԭ���γ�4�����ۼ� | |
| C�� | ����NaOH��Һ�ķ�Ӧ��NaOH�������� | |
| D�� | ��Ԫ���ڵؿ��еĺ����ӵ�һλ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com