
| A. | 元素W与氢形成原子比为1:1的化合物有多种 | |
| B. | 元素X的单质能与水、无水乙醇反应 | |
| C. | 离子Y3+与Z-的最外层电子数和电子层数都不相同 | |
| D. | 元素W与元素Z可形成含有极性共价键的化合物 |
分析 W、X、Y、Z为短周期主族元素,原子序数依次增加,W的一种核素在考古时常用来鉴定一些文物的年代.说明W为C,化合物XZ是重要的调味品为NaCl,Y位于XZ之间说明原子有三个电子层,Y原子的最外层电子数等于其电子层数,则Y为Al,Z-的电子层结构与氩相同判断为Cl-,W、X、Y、Z为C、Na、Al、Cl,据此分析选项.
解答 解:A.元素W为C与氢形成原子比为1:1的化合物有多种,如C2H2、C4H4、C6H6、C8H8等,故A正确;
B.元素X为钠,属于活泼金属,钠的单质能与水剧烈反应生成氢氧化钠和氢气,钠和无水乙醇反应生成乙醇钠和氢气,故B正确;
C.离子Y3+离子为Al3+,有两个电子层,最外层8个电子,Z-为Cl-最外层电子数为8,电子层数为三个电子层,最外层电子数相同,电子层数不相同,故C错误;
D.元素W为C与元素Z为Cl可形成含有极性共价键的化合物,如CCl4,是含有极性共价键的化合物,故D正确;
故选C.
点评 本题考查原子结构与元素周期律知识,侧重于学生的分析能力的考查,把握原子结构特点为解答该题的关键,注意原子结构和离子结构的分析应用,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 石油的主要成分是碳氢化合物 | |
| C. | 乙炔是含碳量最高的碳氢化合物 | |
| D. | 分子式为C4H10的烃有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
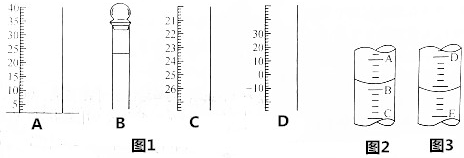
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 100mLpH=2的新制氯水中,:N(OH-)+2N(ClO-)+N(HClO)=0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
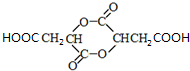 .
.  .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

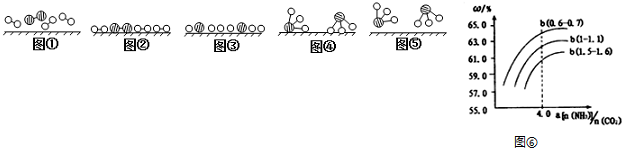
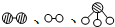 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.6 mol•(L•s)-1 | |
| B. | 2 s时物质B的浓度为1.4 mol•L-1 | |
| C. | 2 s时物质A的转化率为70% | |
| D. | 2 s时物质A的体积分数为$\frac{14}{27}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.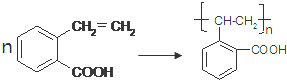 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com