
分析 (1)保持容器体积不变,再向其中充入1mol N2,反应物浓度增大;
(2)保持容器体积不变,再向其中充入1mol氩气,反应体系中各物质浓度不变;
(3)保持容器气体压强不变,再向其中充入1mol N2 和3mol H2,物质的量与体积均为原来的2倍,但浓度不变;
(4)使用催化剂,降低反应所需的活化能.
解答 解:(1)若保持容器体积不变,再向其中充入1mol N2,反应速率会加快,因增大了反应物的浓度,活化分子数目增多,反应速率加快,
故答案为:加快;增大了反应物的浓度,活化分子数目增多,反应速率加快;
(2)若保持容器体积不变,再向其中充入1mol氩气,反应速率会不变,因反应物的浓度没有增大,反应速率就不会加快,
故答案为:不变;反应物的浓度没有增大,反应速率就不会加快;
(3)若保持容器气体压强不变,再向其中充入1mol N2 和3mol H2,反应速率会不变,因在一定温度和压强条件下,气体体积和气体的物质的量成正比,容器的体积增大,反应物的浓度没有增大,反应速率就不会加快,
故答案为:不变;在一定温度和压强条件下,气体体积和气体的物质的量成正比,容器的体积增大,反应物的浓度没有增大,反应速率就不会加快;
(4)使用催化剂,反应速率会加快,因催化剂可以降低反应的活化能,提高活化分子的百分数,反应速率加快,
故答案为:加快;催化剂可以降低反应的活化能,提高活化分子的百分数,反应速率加快.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、催化剂对反应的影响等为解答的关键,侧重分析与应用能力的考查,注意活化理论的应用,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题

| A. | 铜片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 如果将铜片换成铁片,电路中的电流方向将改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )| A. | 电池工作时,电子从电极a经负载流向电极b | |
| B. | 实际工作中当反应生成64gS2时,电池内部释放632kJ电能 | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 当电路中通过4mol电子时,有4mol H+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池为电解池,乙池为原电池 | |
| B. | 工作时需不断地向甲池中加入H2O2 | |
| C. | a电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| D. | 工作时需不断地向甲池中加入适量烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
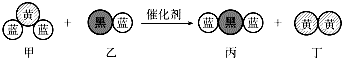
| A. | 若蓝、黑球原子的相对质量之比为4:3,则乙、丙两物质的摩尔质量之比为7:11 | |
| B. | 若乙丙中蓝球元素显相同负价,则乙中黑球元素失去电子,被氧化 | |
| C. | 若甲中黄球元素显正价,则丁为还原产物 | |
| D. | 化学方程式中乙、丁的化学计量数均为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.1mol•L-1的稀硫酸中含有SO42-个数为0.1NA | |
| B. | 含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2 NA | |
| C. | 4℃时,5.4mL水中所含的水分子数是0.3NA | |
| D. | 标准状况下,22.4L氢气所含的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期在含有高浓度的二氧化硅粉尘的环境中工作,易患矽肺病 | |
| B. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于传统无机非金属材料 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 只用米汤就能检验出食盐中是否有碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 | H2O2 | O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
| A. | 表中①反应的氧化产物只能有FeCl3 | |
| B. | 表中②生成1mol的O2将有4mol的电子转移 | |
| C. | 还原性比较:H2O2>Mn2+>Cl- | |
| D. | 表中④的离子方程式配平后,H+的化学计量数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①②④⑥ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com