
 ;
; ;
;分析 A元素原子中没有中子,且A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一,此强酸应为盐酸,即A为H元素,D为Cl元素;
C元素最外层电子数是次外层的3倍,次外层只能是2,那么最外层是6,那么C为O元素;
bB与cC两种元素存在关系:b=c-1,B、C形成的一种气态化合物呈红棕色,那么B为N元素;
A为H,B为N,C为O,核外电子总数=1+7+8=16,比D(17)少1,故满足题意,据此解答各小题即可.
解答 解:A元素原子中没有中子,且A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一,此强酸应为盐酸,即A为H元素,D为Cl元素;
C元素最外层电子数是次外层的3倍,次外层只能是2,那么最外层是6,那么C为O元素;
bB与cC两种元素存在关系:b=c-1,B、C形成的一种气态化合物呈红棕色,那么B为N元素;
经验证:A为H,B为N,C为O,核外电子总数=1+7+8=16,比D(17)少1,故推断正确;
(1)D为Cl,处于元素周期表中第三周期第VIIA族,故答案为:第三周期第VIIA族;
(2)B为N元素,原子序数为7,有2个电子层,最外层电子数为5,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)氨气中存在三对N-H共价键,电子式为: ,故答案为:
,故答案为: ;
;
(4)实验室是用二氧化锰和浓盐酸反应制氯气,反应生成氯气、二氯化锰、水,依据离子方程式书写方法,易溶于水的强电解质拆成离子,离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O.
点评 本题考查了制取氯气实验相关内容的探究,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
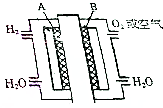 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
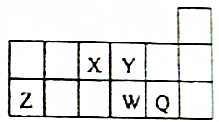 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
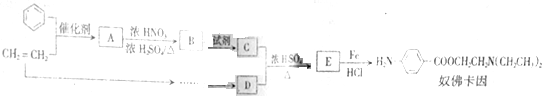
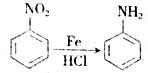
 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.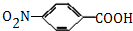 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
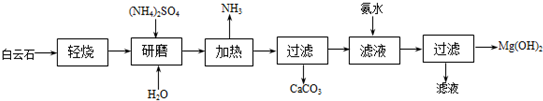
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com