
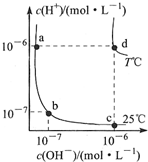
| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
分析 A、d点所在的温度下,水的离子积Kw=10-12;
B、向a点对应的醋酸溶液中滴加NaOH溶液至b点,溶液显中性,即c(H+)=c(OH-);
C、T℃时,水的离子积Kw=10-12.
D、酸对水的电离有抑制作用,盐的水解对水的电离有促进作用.
解答 解:A、d点所在的温度下,水的离子积Kw=10-12,而食盐水溶液永远显中性,故在d点温度下,食盐水的pH=6,故A正确;
B、向a点对应的醋酸溶液中滴加NaOH溶液至b点,溶液显中性,即c(H+)=c(OH-),而根据电荷守恒可知:
c(H+)+c(Na+)=c(CH3COO-)+c(OH-),故有c(Na+)=c(CH3COO-),故B正确;
C、T℃时,水的离子积Kw=10-12,0.05mol/LBa(OH)2溶液中,氢氧根的浓度c(OH-)=0.1mol/L,则有:c(H+)=10-11mol/L,则pH=11,故C正确;
D、酸对水的电离有抑制作用,盐的水解对水的电离有促进作用,故a点对应的稀硫酸溶液中水的电离程度小于醋酸钠溶液中的水的电离程度,故D错误.
故选D.
点评 本题考查了水的离子积和盐类水解中的电荷守恒以及酸碱和盐的水解对水的电离的影响,难度中等,属于高考常考的题型.


科目:高中化学 来源: 题型:选择题
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
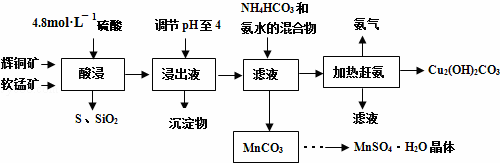
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
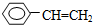
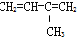
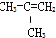
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
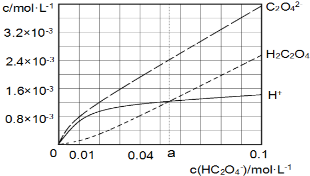 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com