
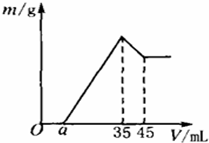
 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,求:| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.175mol |
| 0.1L |
| 1 |
| 2 |
| 0.027mol |
| 3 |
| 1 |
| 2 |
| 0.9g |
| 160g/mol |
| 0.33375mol |
| 10mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.若将FeCl3溶液腐蚀印刷电路铜板的反应设计成原电池,请画出原电池的装置图标出正、负极,
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.若将FeCl3溶液腐蚀印刷电路铜板的反应设计成原电池,请画出原电池的装置图标出正、负极,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制取乙酸乙酯 |
B、 用石灰石和稀盐酸制取二氧化碳 |
C、 蒸馏石油 |
D、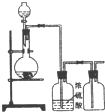 锌和稀硫酸制取、净化并收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ |
| C、①④⑤ | D、①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com