
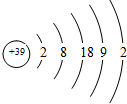
| A、该元素位于第5周期,ⅢB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有3个电子 |
| D、该元素原子M能层共有18个电子 |
 ,
,

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
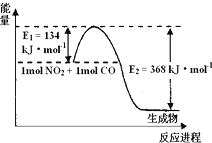 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②③ |
| C、②③④ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com