
| A. | 50℃时,测定某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | NaHSO3水溶液中存在关系:c(H2SO3)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| |||||||||
| D. | 已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-7Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
分析 A.pH=8的溶液中的氢离子浓度为1×10-8mol•L-1,由于缺少该温度下水的离子积,无法计算氢氧根离子浓度,则无法计算c(Na+)-c(NO2-)的值;
B.亚硫酸氢根离子的水解程度较小,则c(H2SO3)+c(H+)<c(HSO3-);
C.0.1mol/L的醋酸溶液中的pH=3,据此可计算出氢离子浓度,然后再计算出醋酸的电离程度;
D.HCN的电离程度大于碳酸氢根离子,说明HCN的酸性大于碳酸氢根离子,则二氧化碳与NaCN溶液反应生成碳酸氢钠,不会生成碳酸钠.
解答 解:A.50℃时,测定某NaNO2溶液的pH=8,溶液中的氢离子浓度为1×10-8mol•L-1,根据电荷守恒可知c(Na+)-c(NO2-)=c(OH-)-c(H+),由于缺少水的离子积,无法计算氢氧根离子浓度,则无法计算c(Na+)-c(NO2-)的值,故A错误;
B.由于亚硫酸氢根离子的水解程度不大,则NaHSO3水溶液中一定满足:c(H2SO3)+c(H+)<c(OH-)+c(SO32-)+c(HSO3-),故B错误;
C.0.1mol/L的醋酸溶液的pH=3,氢离子浓度为0.001mol/L,由于水电离的氢离子浓度较小,则发生电离的醋酸的物质的量约为0.001mol/L,所以醋酸的电离度为:$\frac{0.001mol/L}{0.1mol/L}$×100%=1%,故C正确;
D.25℃时HCN的Ka=4.9×10-10,H2CO3的Ka2=5.6×10-11,HCN的电离程度大于碳酸氢根离子,说明HCN的酸性大于碳酸氢根离子,则二氧化碳与NaCN溶液反应生成碳酸氢钠,正确的反应为:NaCN+H2O+CO2=HCN+NaHCO3,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离平衡及其应用、盐的水解原理、离子浓度大小比较等知识,明确电荷守恒的含义、电离平衡及其影响为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 物质内部储存的能量--化学反应的热效应 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 原子核外电子排布--元素在周期表中的位置 | |
| D. | 有效碰撞几率的高低--化学反应速率的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
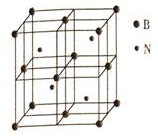 氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,
氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
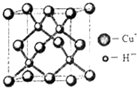 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减少环境污染,常使用乙醇汽油代替化石燃料,乙醇可通过纤维素转化制得,是一种可再生的燃料 | |
| B. | 优良的催化剂可以降低反应温度,起到节能效果并提高反应物的转化率 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
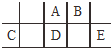 短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是( )| A. | A有5种正价,与B可形成6种化合物 | |
| B. | 工业上常通过电解熔融态C2B3的方法来获得C的单质 | |
| C. | 简单离子的半径由大到小为:E>A>B>C | |
| D. | D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com