
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A的最外层电子数是次外层电子数的两倍,C是该周期中原子半径最大的元素,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。试根据以上叙述回答:
(1)元素符号:B______;C______;E______ ;
(2)画出D的离子结构示意图_______________;AB2的结构式_______________;
(3)写出C2B2与AB2反应的化学方程式___________________________________________;在该反应中,1mol C2B2参与反应,则转移电子数目为______;
(4)D、E的气态氢化物的稳定性_________大于_________ (填化学式)。
【答案】 O Na Cl ![]() O=C=O 2Na2O2+2CO2=2Na2CO3+O2 NA或6.02×1023 HCl H2S
O=C=O 2Na2O2+2CO2=2Na2CO3+O2 NA或6.02×1023 HCl H2S
【解析】A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的最外层电子数是次外层电子数的两倍,最外层电子数不超过8个,K层不超过2个,则A原子次外层为K层,则A是C元素;A和B原子具有相同的电子层数,则B为第二周期元素;C是该周期中原子半径最大的元素,且C原子序数大于B,所以C为第三周期元素,为Na元素;C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,则B单质是氧气,B为O元素,D是S元素,E与D相邻,且原子序数大于D,所以E是Cl元素;
(1)通过以上分析知,B、C、E分别是氧、钠、氯元素,元素符号依次为O、Na、Cl;
(2)D是S元素,其原子核外有3个电子层、最外层有6个电子,其原子结构示意图为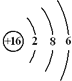 ;CO2是直线型结构,其结构式为O=C=O;
;CO2是直线型结构,其结构式为O=C=O;
(3)Na2O2与CO2发生反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=2Na2CO3+O2↑,此反应中Na2O2既是氧化剂,又是还原剂,氧元素的化合价从-1价升高为0价,当该反应中,1mol Na2O2参与反应,则转移电子数目为NA或6.02×1023;
(4)D是S元素、E是Cl元素,非金属性Cl>S,则氢化物的稳定性大小为:HCl>H2S。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制480 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO ![]() 及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液.正确的操作顺序可以是( )
及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液.正确的操作顺序可以是( )
A.⑤②④③①
B.④①②⑤③
C.②⑤④①③
D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据我国统一实行法定计量单位的规定,下列说法比较规范的是
A.98g硫酸的摩尔数为1 mol
B.氧的摩尔质量为32g/mol
C.某硫酸中H2SO4的质量分数为0.60
D.阿伏加德罗常数约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:将V1 mL 1.0molL﹣1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空:

(1)该实验表明此反应 (填吸收、释放)能量,即: 能可以转化为 能,通过甲图示分析可以得出:做该实验时,环境温度 (填高于、低于、等于)22℃;
(2)根据甲图示计算该NaOH溶液的浓度约是 molL﹣1
(3)如图乙所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:
①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体
其中能使a端液面高于b端液面的是 .(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com