
【题目】现有如下两个反应:(A)Cu2++Zn=Cu+Zn2+(B)2FeCl3+Cu=2FeCl2+CuCl2。
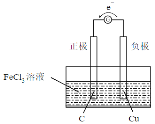
(1)分别画出两个实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向___、___。
(2)写出下列电极反应式:
①(A)中___是负极,负极反应式:___;
②(B)中___是负极,负极反应式:___。
【答案】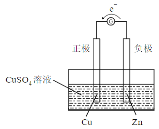
 Zn Zn-2eˉ=Zn2+ Cu Cu-2eˉ=Cu2+
Zn Zn-2eˉ=Zn2+ Cu Cu-2eˉ=Cu2+
【解析】
(1)反应(A)Cu2++Zn=Cu+Zn2+中Cu2+被还原为正极反应,Zn被氧化为负极反应,所以原电池负极材料为Zn,电解质溶液可以选用可溶性铜盐如硫酸铜,正极材料可以选用Cu棒;原电池中电子由负极经外电路流向正极,装置图为: ;
;
反应(B)2FeCl3+Cu=2FeCl2+CuCl2中Fe3+被还原为正极反应,Cu被氧化为负极反应,所以原电池的负极材料为Cu,电解质溶液为FeCl3溶液,正极材料可以使C棒;原电池中电子由负极经外电路流向正极,装置图为: ;
;
(2)①(A)中Zn发生氧化反应为负极,电极反应式为Zn-2eˉ=Zn2+;
②(B)中Cu发生氧化反应为负极,电极反应式为Cu-2eˉ=Cu2+。


科目:高中化学 来源: 题型:
【题目】有机物A分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是( )
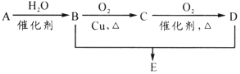
A.75%(体积比)的B溶液常用于医疗消毒
B.D、E都能与NaOH溶液反应
C.由B、D制备E常用浓硫酸作脱水剂
D.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
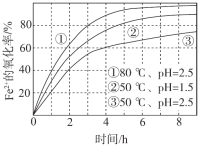
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() →
→![]() +HBr;
+HBr;![]() +H2→
+H2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 。
A.水
B.稀硫酸
C.溴水
D.酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 。
(3)某同学在学习A的知识后,设计了如下实验。操作步骤为:
①在试管里加入2 mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
第④步操作中,铜丝表面的变化是 ;写出第③步操作中发生反应的化学方程式: 。
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
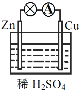
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件和医药及化工等领域。
Ⅰ.(1)锑在元素周期表中的位置_____。
(2)锑(Ⅲ)的氧化物被称为锑白,可以由SbCl3水解制得,已知SbCl3水解的最终产物为锑白。为了得到较多、较纯的锑白,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量氨水。试用必要的化学用语和平衡移动原理解释这两项操作的作用_______。工业上,还可用火法制取锑白,是将辉锑矿(主要成分为Sb2S3)装入氧化炉的坩埚中,高温使其融化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式______。
Ⅱ.以辉锑矿为原料制备金属锑,其中一种工艺流程如下:
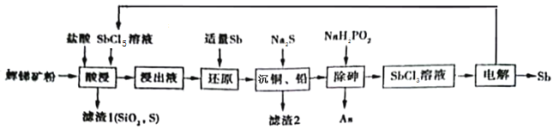
已知部分信息如下:
①辉锑矿(除Sb2S3外,还含有砷、铅、铜的化合物和SiO2等);
②浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
③常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(3)“酸浸”过程中Sb2S3发生反应的化学方程式为_____。
(4)已知:浸出液中c(Cu2+)=0.0001mol/L,c( Pb2+)=0.1mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生沉淀的是_____(填化学式);当CuS、PbS共沉沉时,![]() =______(保留小数点后一位)。
=______(保留小数点后一位)。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应氧化产物与还原产物的物质的量之比为__________。
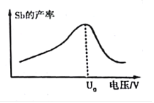
(6)在“电解”过程中,锑的产率与电压大小关系如图所示。当电压超过U0 V时,锑的产率降低的原因可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
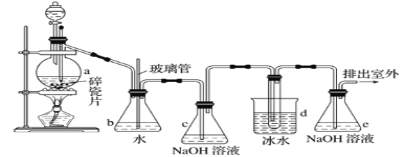
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是
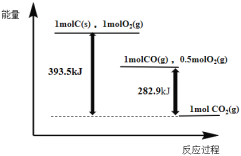
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH= 221.2 kJmol1
C.反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com