
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
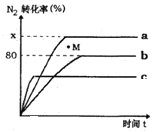
①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
【答案】(1) 2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol (2) ①c ②800 ③小于 (3)2NO2-+6e-+4H2O= N2+ 8OH- 22.4L (4) ①该反应的K=Ksp·Kβ=1.6×10-7<10-5所以反应很难进行 ②固体溶解,得到深蓝色溶液 溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动
【解析】本题考查盖斯定律的应用,②×2+③×3/2-①/2得出:2C(石墨)+ 3H2(g)=C2H6(g) △H=-86.4kJ/mol;(2)①恒容绝热容器,正反应是放热反应,随着反应进行,温度升高,化学反应速率升高,先达到平衡,符合条件的曲线是c;② 此反应是气体物质的量减少的,恒温恒容是的反应速率小于恒温恒压,即b为恒温恒容时的曲线,a为恒温恒压时的曲线,化学平衡常数只受温度的影响,温度不变,化学平衡常数不变,即N2+3H2![]() 2NH3
2NH3
起始(mol·L-1) 0.5 1.4 0
变化: 0.4 1.2 0.8
平衡: 0.1 0.2 0.8
根据化学平衡常数的定义,K=c2(NH3)/(NH3)/[c3(H2)×c(N2)]=800;③M点达到b曲线上,N2的转化率降低,说明反应向逆反应方向移动,即v(正)<v(逆);(3)根据电解的原理,阴极上得到电子,化合价降低,根据信息NO2-→N2,化合价由+3价→0价,NO2-在阴极上放电,因此阴极反应式为:2NO2-+4H2O+6e-=N2+8OH-,阳极上失去电子化合价升高,阴极上收集到11.2L的N2,消耗NO2-的物质的量11.2×2/22.4mol=1mol,NH3在阳极上失电子,根据得失电子守恒,n(NH3)×3=n(NO2-)×3,解得n(NH3)=1mol,合22.4L;(4)①根据平衡常数定义,K=c2(OH-)×c(Cu[NH3]4]2-)/c4(NH3·H2O)= c2(OH-)×c(Cu[NH3]4]2-)×c(Cu2+)/[c4(NH3·H2O) ×c(Cu2+)]=Ksp×Kβ=2.2×10-20×7.24×1012=1.6×10-7<10-5,此反应很难进行;②溶液中存在平衡Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。
[Cu(NH3)4]2++4H2O, 加入硫酸铵固体增大了铵根离子浓度,平衡正向移动,现象是固体溶解,得到深蓝色溶液。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如下8种物质中:①甲烷 ②聚乙烯 ③苯 ④氯乙烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色,又能与溴水起加成反应使之褪色的是
A. ③④⑤⑧ B. ④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12mol/L的盐酸(p=1.19g/㎝3)50mL稀释成6mol/L的盐酸(p=1.10g/㎝3),需加水的体积为
A.50mL B.50.5mL C.55mL D.59.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, 将浓度均为0.1 mol/L、体积分别为Va 和Vb 的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。 下列说法正确的是
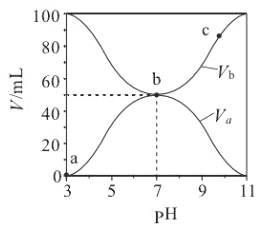
A. Ka(HA)的值与 Kb(BOH) 的值不相等 B. b 点时, 水电离出的 c(H+)=10-7mol/L
C. c 点时, c(A-) > c(B+) D. a→c 过程中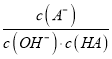 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g) ![]() CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:

已知:TON=![]()
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青霉素是常用抗生素之一,它能抑制某些细菌生长或能杀灭这些细菌,对肺炎、脑膜炎、败血症患者有良好的疗效。使用青霉素前一定要进行皮试,一般做完皮试后等待多长时间观察
A. 1分钟 B. 5分钟
C. 20分钟 D. 1小时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某同学对NaClO的物质组成和分类进行的分析,其中不正确的是( )
A.根据元素组成知道它是化合物
B.因为含有钠离子与氯离子和氧离子,所以该物质是盐
C.该物质可以称为钠盐也可以称为次氯酸盐
D.该物质有强氧化性,生活中可用作消毒剂和漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液显碱性,NaHCO3溶液显酸性
B. 可用加热方法除去NaHCO3固体中的Na2CO3杂质
C. 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液
D. 等质量的Na2CO3、NaHCO3固体分别与足量盐酸反应,后者产生的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
![]()
![]()
![]()
![]() ―→
―→![]() ―→产品
―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.6、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。

(1)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是________,滤渣的主要成分是________。
(2)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入___________;②过滤,得沉淀;③____________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(3)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为____________(MgSO4·7H2O的相对分子质量为246)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com