
【题目】在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9gcm﹣3 , 这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.18.4molL﹣1 34.7%
B.20.4molL﹣1 38.5%
C.18.4molL﹣1 38.5%
D.20.4molL﹣1 34.7%
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学所学的常见物质,它们之间的转化关系如图所示(部分反应条件或产物已略去).请按要求回答下列问题: 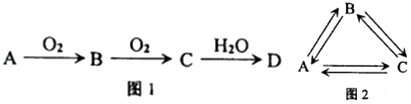
(1)若A、B、C、D均含有同一种短周期元素X,它们的转化关系如图l所示: ①常温下,若A为化合物,C为红棕色气体,D为强电解质,则X所在周期表中的位置是;用方程式表示A溶于水,使酚酞变红的原因:;写出反应C→D的化学方程式 .
②常温下,若A为固体单质,D为强电解质,则D可能的化学式为、;符合上述条件且含有离子键的C的电子式: .
(2)若A、B、C均含有同一种短周期元素Y,它们的转化关系如图2所示: 若Y的周期数等于主族序数;盐A溶液显酸性:盐B溶液显碱性,且焰色反应为黄色;C为两性氢氧化物.
①请写出元素Y的离子结构示意图;
②写出B溶液与A溶液反应生成C的离子方程式: .
③在实验室里,欲使A溶液中的阳离子全部沉淀出来转化为C,最佳方案的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于加成反应的是( )
A.乙烯一定条件下与水反应生成乙醇
B.乙醇与乙酸在浓硫酸作用下加热生成乙酸乙酯
C.苯与液溴混合后撒入铁粉
D.等物质的量的氯气与乙烷在光照条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.任何化学反应都能设计成原电池
B.原电池负极被氧化
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),设计了如下流程: 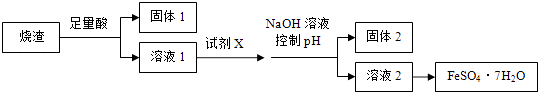 下列说法不正确的是( )
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
A.制高铁酸钾用 KClO做还原剂
B.Fe(OH)3是还原剂
C.高铁酸钾中铁的化合价为+7
D.制备高铁酸钾时1 molFe(OH)3得到3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浑浊的水中加入适量的FeCl3·6H2O并搅拌以后,水便由浑浊变得澄清。在此过程中发生的主要变化( )
A.是纯化学变化
B.是纯物理变化
C.既有化学变化又有物理变化
D.不能确定是化学变化还是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种优质的液体燃料,二甲醚与合成气制乙醇是目前合成乙醇的一种新途径,总反应为:CH3OCH3(g)+CO(g)+2H2 (g)CH3OH(g)+C2H5OH(g).向反应系统中同时通入二甲醚、一氧化碳和氢气,先生成中间产物乙酸甲酯后,继而生成乙醇.发生的主要化学反应有:
反应过程 | 化学方程式 | 不同温度下的K | ||
273.15K | 1000K | |||
Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)CH3COOCH3(g) | 1016.25 | 101.58 |
Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)CH3OH(g)+C2H5OH(g) | 103.97 | 10﹣0.35 |
回答下列问题:
(1)二甲醚碳基化反应的△H0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是 .
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)CH3OH(g)+C2H5OH(g)的平衡常数表达式K= , 随温度的升高,总反应的K将(填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是 , 简要解释产生这种变化的原因 .
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |
①20min时,只改变了某一条件,根据上表中的数据判断改变的条件可能是(填字母).
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线 . 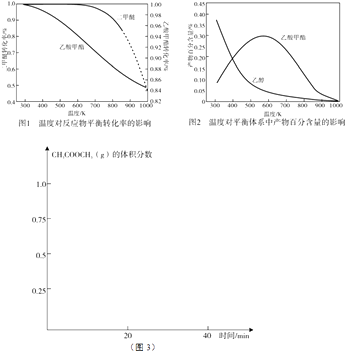
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com