
 Ag++Cl-
Ag++Cl-

 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
| A、58.5g氯化钠中所含的离子数为NA |
| B、25°C 101kPa,64g SO2中含有的原子数为3NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用0.1mol?L-1AgNO3溶液分别滴定20.00mL浓度均为 0.1mol?L-1Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标,pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得如图滴定曲线.已知25℃时:
用0.1mol?L-1AgNO3溶液分别滴定20.00mL浓度均为 0.1mol?L-1Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标,pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得如图滴定曲线.已知25℃时:| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×0-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
| A、用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol?L-1K2CrO4溶液1~2滴作指示剂 |
| B、a、b、c依次分别表示Cl-、Br-及I- |
| C、向NaCl和NaBr的混合溶液中滴加硝酸银溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=2.7×10-3 |
| D、若用硝酸银溶液滴定NaI溶液,当pX=13时,溶液中c(Ag+)≈0.64×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
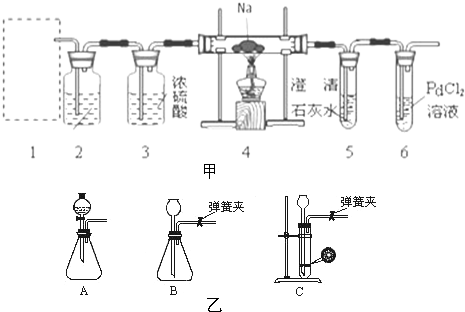
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol?L-1NaOH溶液 | 0.1mol?L-1MgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol?L-1氨水 | 0.1mol?L-1MgCl2溶液 | 无现象 |
| Ⅲ | 1mol?L-1氨水 | 1mol?L-1MgCl2溶液 | 现象III |
| Ⅳ | 1mol?L-1氨水 | 0.1mol?L-1MgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol?L-1氨水 | 1mol?L-1MgCl2溶液 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+比H+的氧化性强,故镁将Fe3+还原完全后再与H+反应 |
| B、镁和生成的铁构成许多微型原电池,故反应剧烈 |
| C、反应放热温度升高,故反应剧烈 |
| D、反应产物含有Fe(OH)3、Fe、H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com