
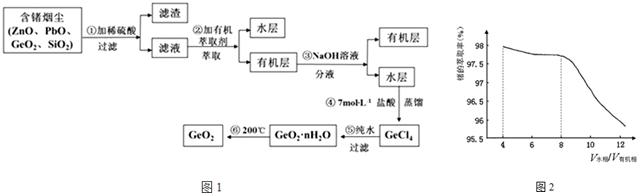
分析 含锗烟尘中含有ZnO、PbO、CeO2、SiO2,加入稀硫酸过滤,溶解的有ZnO、CeO2,第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,滤液中加入有机萃取剂萃取得到有机层萃取层中加入氢氧化钠进行反萃取得到水层,加入盐酸得到GeCl4,加入纯水过滤得到GeO2•nH2O,加热分解得到GeO2;
(1)根据题目中的流程可以看出第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,实验室萃取操作用到的玻璃仪器有分液漏斗、烧杯.
(2)第③步萃取时,从生产成本角度考虑,由图可知有机萃取剂的用量在$\frac{{V}_{水相}}{{V}_{有机相}}$的值为8时比$\frac{{V}_{水相}}{{V}_{有机相}}$的值为4时少,此时萃取率处于较高水平,而有机萃取剂较贵,故$\frac{{V}_{水相}}{{V}_{有机相}}$的值为8时较适宜.
(3)第④步加入盐酸作用为中和NaOH,作反应物,抑制GeCl4水解.
(4)第⑤步反应GeCl4水解得到氯化氢和GeO2?nH2O;
(5)检验GeO2•nH2O是否洗涤干净的操作是取最后一次洗涤液于试管中,检验是否含有氯离子设计实验验证;
(6)设GeO2的物质的量为xmol,SiO2的物质的量为ymol,依据蒸馏和原子守恒列式计算:2(x+y)=0.105 105x+60y=5.4,解得x=0.050,故该样品中GeO2的物质的量为0.050mol.
解答 解:(1)根据题目中的流程可以看出,含锗烟尘中含有ZnO、PbO、CeO2、SiO2,加入稀硫酸过滤,溶解的有ZnO、CeO2,第①步中不溶于稀硫酸的滤渣主要成分有SiO2、PbO,实验室萃取操作用到的玻璃仪器有分液漏斗、烧杯;
故答案为:SiO2、PbO,分液漏斗、烧杯;
(2)第③步萃取时,从生产成本角度考虑,由图可知有机萃取剂的用量在$\frac{{V}_{水相}}{{V}_{有机相}}$的值为8时比$\frac{{V}_{水相}}{{V}_{有机相}}$的值为4时少,此时萃取率处于较高水平,而有机萃取剂较贵,从生产成本角度考虑,故$\frac{{V}_{水相}}{{V}_{有机相}}$的值为8时较适宜;
故答案为:8;
(3)第④步加入盐酸作用为中和NaOH,作反应物,同时抑制GeCl4水解;
故答案为:中和NaOH,作反应物,抑制GeCl4水解;
(4)第⑤步反应是GeCl4水解得到氯化氢和GeO2?nH2O,反应的化学方程式:GeCl4+(n+2)H2O=GeO2?nH2O+4HCl;
故答案为:GeCl4+(n+2)H2O=GeO2?nH2O+4HCl;
(5)检验GeO2•nH2O是否洗涤干净的操作是:取最后一次洗涤液于试管中,往其中加入HNO3酸化的AgNO3溶液,若不产生白色沉淀,则说明洗涤干净.若产生白色沉淀,则说明未洗涤干净;
故答案为:取最后一次洗涤液于试管中,往其中加入HNO3酸化的AgNO3溶液,若不产生白色沉淀,则说明洗涤干净.若产生白色沉淀,则说明未洗涤干净;
(6)GeO2产品中通常混有少量SiO2.取样品5.4g,测得其中氧原子的物质的量为0.105mol,设GeO2的物质的量为xmol,SiO2的物质的量为ymol,
2(x+y)=0.105
105x+60y=5.4,
解得x=0.050,
故该样品中GeO2的物质的量为0.050mol.
故答案为:0.050.
点评 本题考查了物质分离和提纯的方法和实验设计,实验分析,实验现象的理解,流程和图象的特征分析,物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②⑤⑥ | C. | ②③④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com