
| A.二氧化硫气体与硫化氢气体作用生成硫和水 |
| B.二氧化碳气体与氢氧化钠溶液作用生成碳酸钠和水 |
| C.过氧化钠固体与二氧化碳气体反应生成碳酸钠和氧气 |
| D.Zn粒与稀硫酸反应制取氢气 |
科目:高中化学 来源:不详 题型:多选题
| A.该反应中NaH作氧化剂 |
| B.该反应中水的H元素部分被氧化成氢气 |
| C.NaH溶于水后溶液显碱性 |
| D.该反应的氧化产物与还原产物质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| -3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤⑥⑦ | B.①②③④⑤⑥ | C.③④⑤⑥⑦ | D.①②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
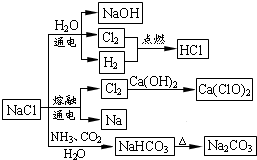
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
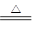 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
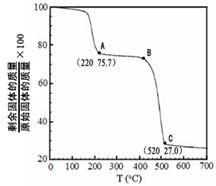
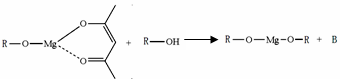
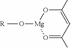 ,它可发生如下反应:
,它可发生如下反应: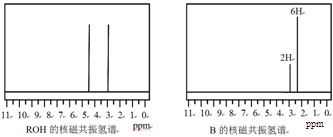
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com