
分析 (1)半导体材料硅是构成太阳能电池的主要成分;
(2)玻璃上雕花时发生氢氟酸与二氧化硅反应生成四氟化硅和水;
(3)碳酸的酸性强于硅酸,强制弱,所以二氧化碳通入硅酸钠中生成硅酸、碳酸钠;
(4)根据硅酸盐化学式可表示为:活泼金属氧化物•金属氧化物•非金属氧化物•水,注意质量守恒进行解答;
解答 解:(1)半导体材料硅是构成太阳能电池的主要成分,故答案为:Si;
(2)玻璃上雕花时发生氢氟酸与二氧化硅反应生成四氟化硅和水,反应方程式为:4HF+SiO2=SiF4↑+2H2O,故答案为:4HF+SiO2=SiF4↑+2H2O;
(3)碳酸的酸性强于硅酸,强制弱,所以二氧化碳通入硅酸钠中生成硅酸、碳酸钠,反应的离子方程式为:SiO32-+CO2+H2O=CO32-+H2SiO3↓,故答案为:SiO32-+CO2+H2O=CO32-+H2SiO3↓;
(4)田玉的化学式为Ca2Mg5H2Si8O24,用氧化物形式可表示为:CaO•Al2O3•2SiO2,故答案为:CaO•Al2O3•2SiO2.
点评 本题考查硅及硅酸盐改写为氧化物的形式的方法,注意硅酸盐改写为氧化物的一般方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br- | |
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、AlO2-、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 熔点/℃ | 沸点/℃ | 水溶性 |
| -59.5 | 11.0 | 极易溶解 |
| A. | 化学方程式中的a=l,b=2 | |
| B. | 草酸起到还原剂的作用 | |
| C. | KC1O3中只有Cl元素被还原 | |
| D. | 在标准状况下生成5.6L C1O2,转移0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )
常温下,用1L1mol•L-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是( )| A. | Na2SO3溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | 当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-) | |
| C. | M 点时溶液中:c(SO32-)>c(HSO3-) | |
| D. | 向N点的吸收液中加水可使溶液的pH由6.2升高到7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
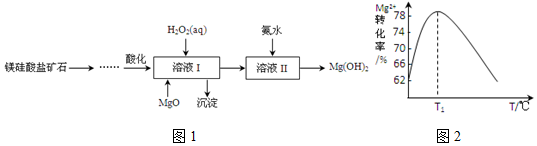
 .溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
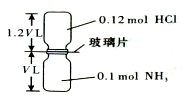 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com