
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强。某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验。根据要求回答问题: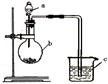
(1)仪器a应盛放的药品是 (填选项)。
A. H2SO4 B. H2SO3 C.H2S D. H2CO3
(2)仪器b应盛放的药品是 (填选项)。
A. Na2SO4 B. Na2CO3 C.NaCl D. CaCO3
(3)仪器c盛放的药品是 ,通过 现象,可以证明得电子能力 比 强。
(5分(1) A (2) B(3)澄清石灰水 c中澄清石灰水变浑浊 硫 碳 (各1分)
解析试题分析:比较C、S元素的最高价氧化物对应的水化物的酸碳酸和硫酸的酸性强弱来证明硫与碳的非金属性的强弱所需进行的反应是硫酸和碳酸盐的反应,强酸可以制得弱酸,所以可以在A中放稀硫酸,在B中放碳酸盐,可用澄清的石灰水来证明二氧化碳的生成,进而确定硫酸可以和可溶性的碳酸盐反应生成碳酸。根据硫酸可以和可溶性的碳酸盐反应可以知道硫酸酸性强于碳酸,而元素的最高价氧化物对应的水化物的酸性越强说明该元素的非金属性越强。
考点:非金属在元素周期表中的位置及其性质递变的规律 比较弱酸的相对强弱的实验
点评:本题通过实验的办法来考查元素周期律的有关知识,设计角度新颖,考查了学生的综合解题能力。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:阅读理解



| 1 |
| 2 |
| 1 |
| 2 |
| YO2 | YO3 | |
| 空气 | 94%-95% | 5%-6% |
| 氧气 | 97%-98% | 2%-3% |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| YO2 | YO3 | |
| 空气 | 94%~95% | 5%~6% |
| 氧气 | 97%~98% | 2%~3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C | 原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.硒的最高价氧化物的化学式为SeO3
B.单质Se是一种半导体材料
C.硒的原子半径比硫、溴的原子半径大
D.单质硒的氧化性比氯气弱,比溴强,比O3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
含有硒(Se)的保键品已进入市场,已知该元素与氧具有相同的最外层电子数。则下列关于硒的叙述中不正确的是
A.最高价氧化物的化学式为SeO3
B.单质Se是一种半导体材料
C.原子半径比硫大,比溴小
D.单质的氧化性比氯气弱,比溴强,比O3弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com