
| A.CO2 | B.NaOH | C.MgCl2 | D.H2O |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:不详 题型:单选题
| A.金属镁形成的晶体中,每个原子周围与其距离最近的原子有12个 |
| B.含有离子键的化合物形成的晶体一定是离子晶体 |
| C.原子晶体中的各相邻原子都以共价键相结合 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
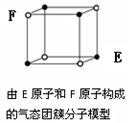
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡 暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题:
灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡 暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
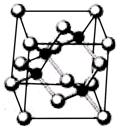
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
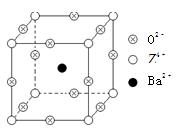
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子化合物一定为离子晶体 |
| B.同周期主族元素的原子半径或离子半径都是从左至右减小 |
| C.氢氧化铁胶体带正电荷,加入电解质会产生红褐色沉淀 |
| D.两个非金属元素的原子之间形成的化学键只能是共价健 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO3和HCl | B.KCl和Mg | C.NaCl和H2O | D.CCl4和SiO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 性键
性键| A.只有②⑤⑥⑦ | B.只有②⑤⑥ | C.只有①②③⑤⑥⑧ | D.只有②③⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com