
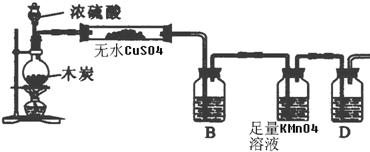
 2SO2↑+CO2↑+2H2O,碳由0价升高为+4价,生成1个CO2↑转移4个电子,如果有0.2mol电子转移,则在标准状况下产生0.05molCO2,0.1molSO2,气体的体积为0.15×22.4L/mol=3.36L,
2SO2↑+CO2↑+2H2O,碳由0价升高为+4价,生成1个CO2↑转移4个电子,如果有0.2mol电子转移,则在标准状况下产生0.05molCO2,0.1molSO2,气体的体积为0.15×22.4L/mol=3.36L, 2SO2↑+CO2↑+2H2O;3.36;
2SO2↑+CO2↑+2H2O;3.36;

科目:高中化学 来源: 题型:
 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.| 催化剂 |
| △ |
| 催化剂 |
| △ |

 或CH3-CH2=CH2+Br2--→CH3-CH2-CH2
或CH3-CH2=CH2+Br2--→CH3-CH2-CH2 或CH3-CH2=CH2+Br2--→CH3-CH2-CH2
或CH3-CH2=CH2+Br2--→CH3-CH2-CH2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com