
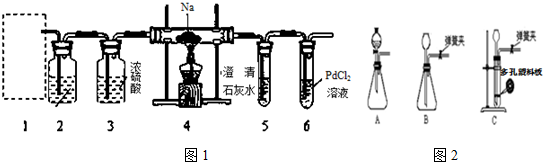
分析 (1)据钠的保存需要考虑钠的性质,如钠与空气和水发生反应,与四氯化碳、汽油、煤油不反应,钠的密度比四氯化碳小、比煤油、汽油的密度大以及汽油的沸点低于煤油,易挥发.金属钠通常保存在煤油中,需要用到的实验用品有镊子、滤纸、玻璃片和小刀等;
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置,根据装置特点确定检验所选装置的气密性的方法;
(3)由实验方案图可知装置b是除去二氧化碳中的HCl,应用饱和的碳酸氢钠溶液;
(4)取最后一次洗涤液加入稀H2SO4,不出现浑浊说明沉淀洗涤干净;根据步骤A装置6中有黑色沉淀生成,可知钠与二氧化碳反应生成了一氧化碳,草酸被高锰酸钾溶液氧化为二氧化碳,高锰酸钾被还原为锰离子;利用高锰酸钾溶液紫红色指示反应终点.
解答 解:(1)金属钠与煤油不反应,且密度比煤油大,沉于煤油底部,隔开了空气,所以钠能保存在煤油中,实验室取用少量金属钠时,需要镊子夹取钠、用滤纸吸煤油,
故答案为:煤油;需要镊子夹取钠、用滤纸吸煤油;
(2)制取二氧化碳时,为了使制气过程具有“随开随用,随关随停”的特点,应该选用能够可以固、液药品分开的装置,A中只能控制反应的速率,但不能控制反应的随时进行与停止;而C中当打开止水夹时,酸就和有孔塑料板上的石灰石反应生成气体,当关闭止水夹时,生成的气体就无法从导管中排出,从而使装置内的压强增大,把酸液挤到长颈漏斗中,使固液分离,故选C.
故答案为:C;
(3)由实验方案图可知,a为二氧化碳发生装置,d为二氧化碳与钠反应装置,加入d装置的二氧化碳应干燥,没有其它,故装置b是除去二氧化碳中的HCl,应用饱和的碳酸氢钠溶液,
故答案为:B;
(4)①草酸被高锰酸钾溶液氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
②根据步骤A装置6中有黑色沉淀生成,可知钠与二氧化碳反应生成了一氧化碳;步骤C中最终所得固体质量为2.00g为碳酸钙,说明反应生成碳酸钠,根据碳元素守恒可知,碳酸钠的物质的量=$\frac{2.00g}{100g/mol}$=0.02mol,故34.6g固体物质中碳酸钠的物质的量为0.02mol×$\frac{250}{25}$=0.2mol,其质量=0.2mol×106g/mol=21.2g;
根据步骤B取反应后直玻管中的固体物质34.6g溶于足量的水中,无气泡产生且得到澄清的溶液,可知固体中有氧化钠,质量为34.6g-21.2g=13.4g,物质的量为$\frac{12.4g}{62}$=0.2mol,根据Na2O和Na2CO3物质的量之比为 0.2mol:0.1mol=2:1,利用元素守恒和电子守恒配平反应方程式为:6Na+4CO2 $\frac{\underline{\;\;△\;\;}}{\;}$2Na2O+Na2CO3+3CO,
故答案为:6Na+4CO2 $\frac{\underline{\;\;△\;\;}}{\;}$2Na2O+Na2CO3+3CO.
点评 本题考查物质组成与探究,涉及对实验方案的理解、实验基本操作、化学计算与数据处理等,确定生成物的成分以发生的反应是难度,也是易错点,题目难度较大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中所有元素的化合价都发生变化 | |
| C. | 任何一个置换反应一定属于氧化还原反应 | |
| D. | 没有单质参与的化合反应和没有单质生成的分解反应不可能是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验方法 |
| 证明地瓜粉中有淀粉 | B |
| 检验酒精中是否含有水 | C |
| 证明NaOH溶液呈碱性 | D |
| 除去FeCl2溶液中少量的FeCl3 | A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
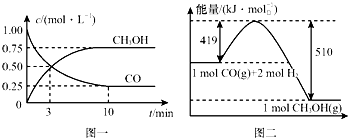
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.| 容器 | 反应物 投入的量 | 反应物的 转化率 | CH3OH 的浓度 | 能量变化(Q1、 Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1 kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2 kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
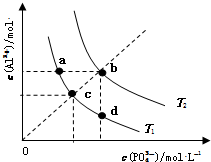
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)═4 NO(g) K=400 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| B. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| C. | SO2催化氧化生成SO3的反应,往往需要使用催化剂 | |
| D. | 红棕色的NO2加压后颜色先变深后变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com