
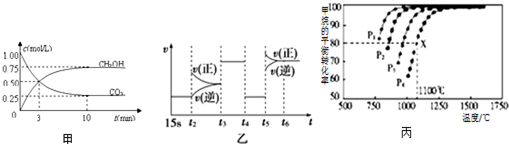
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
分析 Ⅰ.(1)根据v=$\frac{△c}{△t}$计算;根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(2)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动;
(3)t5时刻正逆反应速率都增大,且平衡正向进行,依据选项分析,
A.若是升高温度,反应是放热反应,升温平衡逆向进行不符合;
B.增大反应物浓度,正反应速率瞬间增大,此时逆反应速率不变;
C.催化剂同等程度改变正逆反应速率;
D.增大压强平衡正向进行,反应速率增大;
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,计算Qc和平衡常数K比较判断反应进行的方向;
(5)a.CO的物质的量不再发生变化,说明达平衡状态;
b.混合气体的密度一直不发生变化,不一 定是平衡状态;
c.v正(CO2)=$\frac{1}{2}$v正(H2)=2v逆(H2),所以不是平衡状态;
d.混合气体压强不再发生变化,说明物质的量不变,达平衡状态;
e.单位时间内生成n mol CH4的同时消耗2nmolH2都反映的量逆向,未体现正与逆的关系;
(6)增大压强,平衡向气体体积减小的方向移动;
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1mol的CH4与CO2,相当在原来的基础上增大压强,平衡逆向移动;
(8)已知①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,据盖斯定律,①-②得:CO2(g)+H2(g)?CO(g)+H2O(g)△H=△H1-△H2;所以K=$\frac{{K}_{1}}{{K}_{2}}$;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热.
解答 解:(1)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.5 1.5 0.5 0.5
3nim(mol/L):0.5 1.5 0.5 0.5
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{1.5mol/L}{3min}$=0.5 mol•L-1•min-1,
利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:0.5;5.33;
(2)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.充入惰性气体,使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,反应速率减小,平衡向正反应方向移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C错误;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大反应速率增大,平衡向正反应方向移动,则$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确.
故答案为:D;
(3)t5时刻正逆反应速率都增大,且平衡正向进行,依据选项分析,
A.若是升高温度,反应是放热反应,升温平衡逆向进行,图象中反应速率变化不符合,故A错误;
B.增大反应物浓度,正反应速率瞬间增大,此时逆反应速率不变,图象速率曲线不符合,故B错误;
C.催化剂同等程度改变正逆反应速率,平衡不变,故C错误;
D.增大压强平衡正向进行,正逆反应速率增大,故D正确;
故答案为:D;
(4)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,计算浓度商Q=$\frac{1.75×1.75}{1.25×1.7{5}^{3}}$=0.46<K=5.33,反应正向进行,
故答案为:正向;
(5)a.CO的物质的量不再发生变化,说明达平衡状态,故a正确;
b.混合气体的密度一直不发生变化,不一 定是平衡状态,故b错误;
c.v正(CO2)=$\frac{1}{2}$v正(H2)=2v逆(H2),所以不是平衡状态,故c错误;
d.混合气体压强不再发生变化,说明物质的量不变,达平衡状态,故d正确;
e.单位时间内生成n mol CH4的同时消耗2nmolH2都反映的量逆向,未体现正与逆的关系,故e错误,
故答案为:ad;
(6)压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,由小到大的顺序为P1<P2<P3<P4,故答案为:P1<P2<P3<P4;
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1mol的CH4与CO2,相当在原来的基础上增大压强,平衡逆向移动,放出的热量应减小,故答案为:<;
(8)已知①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,据盖斯定律,①-②得:CO2(g)+H2(g)?CO(g)+H2O(g)△H=△H1-△H2;所以K=$\frac{{K}_{1}}{{K}_{2}}$;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热,故答案为:吸.
点评 本题考查了平衡受温度、压强的影响而移动的问题和平衡状态的判断,注意看准图象是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2L1mol/LNaF溶液中含Na+和F-之和为4NA | |
| B. | 在常温常压下,22gCO2含有的共用电子对数为2NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 11mol甲基(-CH3)中所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定都能与水反应生成酸 | |
| B. | 某溶液加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含有SO42- | |
| C. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 现代化学分析测试常借助一些仪器来分析物质组成,如用原子吸收光谱确定物质中含有那些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
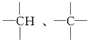 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ④⑤⑥ | C. | ②④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K值不变,平衡一定不移动 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值一定变化 | D. | 平衡移动,K值一定不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
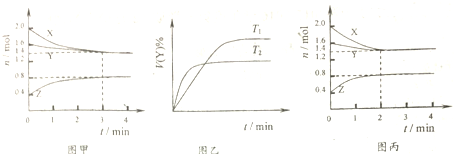
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
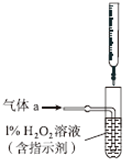 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一元取代物没有同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com