
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的PH值 | 1.5 | 3.3 | 9.4 |
| ||


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
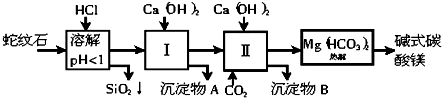
| 试剂a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(ml) | 标准盐酸体积(ml) | |
| 滴定前刻度(ml) | 滴定后刻度(ml) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
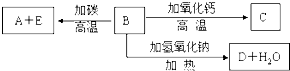
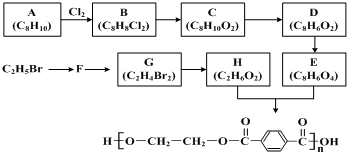
查看答案和解析>>
科目:高中化学 来源: 题型:
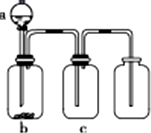 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀硫酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物:干冰、冰水混合物、烧碱、小苏打 |
| B、非电解质:乙醇、四氯化碳、氯气、葡萄糖 |
| C、胶体:泥水、豆浆、有色玻璃、云、雾 |
| D、混合物:铝热剂、纯净矿泉水、水玻璃、漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
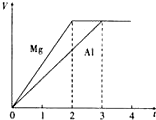 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com