
| A. | pH=1 的H2SO4溶液中所含H+的个数为0.1NA | |
| B. | 100mL 0.1mol•L-1的NH4Cl溶液所含NH4+的个数为0.01NA | |
| C. | 电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g | |
| D. | 将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA |
分析 A、溶液体积不明确;
B、NH4+是弱碱阳离子,在溶液中会水解;
C、电解精炼铜的过程中,阴极反应:Cu2++2e-=Cu;
D、二氧化硫和氧气的为可逆反应,不能进行彻底.
解答 解:A、溶液体积不明确,故溶液中的氢离子的个数无法计算,故A错误;
B、NH4+是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.01NA个,故B错误;
C、电解精炼铜的过程中,阴极反应:Cu2++2e-=Cu,故当外电路转移NA个电子即1mol电子时,阴极生成0.5mol铜,质量为32g,故C正确;
D、二氧化硫和氧气的为可逆反应,不能进行彻底,故生成SO3的分子数小于2NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 增加CO,CO的平衡转化率增大 | |
| D. | 若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该反应的反应类型是加成反应.
,该反应的反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型 | B. | 氨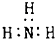 | ||
| C. | Cl-离子的结构示意图 | D. | 8个中子的碳原子的符号${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国结附着在水膜表面主要受水的表面张力影响 | |
| B. | 太空水球中存在分子间作用力和氢键 | |
| C. | 红色液体均匀的分散在水球中,说明分子是在不断做无规则运动 | |
| D. | 红色液体均匀的分散在水球中属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
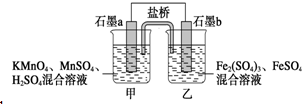 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入少量C,正反应速率增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入CO,混合气体的密度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com