
| A. | 0.8mol/(L•s) | B. | 2.0mol/(L•s) | C. | 4.0mol/(L•s) | D. | 6.0mol/(L•s) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
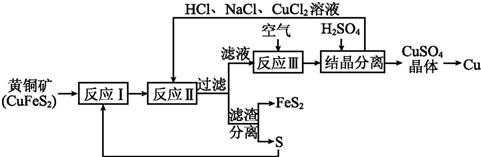
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
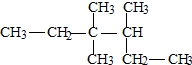
| A. | 3,4,4-三甲基己烷 | B. | 3,3-二甲基-2-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,3-二甲基-4-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
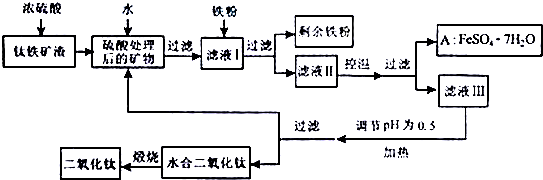
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
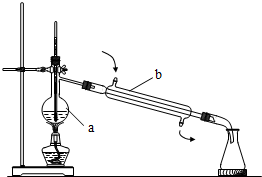 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
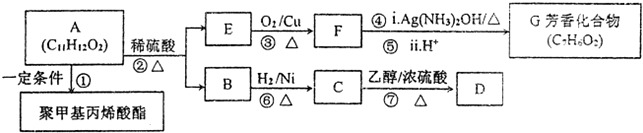
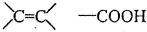 ;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂).
;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂). .
. (CH3)2CHCOOCH2CH3+H2O.
(CH3)2CHCOOCH2CH3+H2O.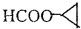 .
.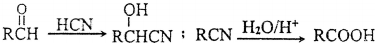
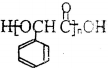 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
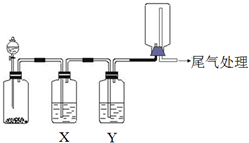 利用如图装置可以进行实验并能达到实验目的是( )
利用如图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 溶液 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com