
分析 水的电离是吸热反应,升高温度促进水电离,导致水的离子积常数增大;pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,混合溶液呈碱性,混合溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-10}}$mol/L=0.001mol/L,c(OH-)=$\frac{c(O{H}^{-}).V(NaOH)-c({H}^{+})V({H}_{2}S{O}_{4})}{V(NaOH)+V({H}_{2}S{O}_{4})}$.
解答 解:水的电离是吸热反应,升高温度促进水电离,导致水的离子积常数增大,该温度下的离子积常数大于25℃时的离子积常数,说明该温度大于25℃;
pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的硫酸溶液中c(H+)=0.1mol/L,混合溶液呈碱性,混合溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-10}}$mol/L=0.001mol/L,c(OH-)=$\frac{c(O{H}^{-}).V(NaOH)-c({H}^{+})V({H}_{2}S{O}_{4})}{V(NaOH)+V({H}_{2}S{O}_{4})}$=$\frac{0.01mol/L×aL-0.1mol/L×bL}{(a+b)L}$=0.001mol/L,a:b=101:9,
故答案为:>;101:9.
点评 本题考查酸碱混合溶液定性判断及pH有关计算,为高频考点,侧重考查学生分析计算能力,明确混合溶液pH计算方法是解本题关键,注意该温度下的离子积常数不是1×10-14,为易错题.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑥⑨⑩ | B. | ①③④⑦⑧⑨⑩ | C. | ①②③④⑦⑧⑨ | D. | ①②④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
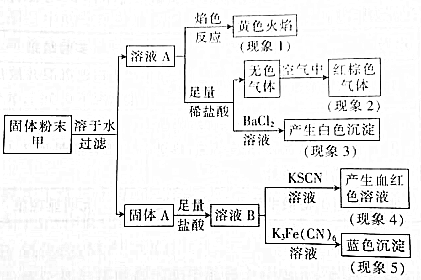
| A. | 根据现象1可推出该固体粉末中含有钠元素,可能含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定含有NaNO3 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的水溶液能导电,因此NH3是电解质 | |
| B. | 焰色反应是物理变化 | |
| C. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| D. | 蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 各一个,-CH3若干个,该烷烃的可能结构有3种.
各一个,-CH3若干个,该烷烃的可能结构有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉在1.12L(标准状况下)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 标准状况下22.4LSO3含氧原子数为3NA | |
| C. | 10g H218O中所含的中子数为5NA | |
| D. | 11.2L 的CO气体与0.5molN2所含的电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com