
在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)以极性键相结合,具有正四面体结构的非极性分子是 。
(2)以极性键相结合,具有三角锥型结构的极性分子是 。
(3)以极性键相结合,具有V型结构的极性分子是 。
(4)以极性键相结合,而且分子极性最大的是 。
(5)CO32-的空间构型为
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
右图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+
通过。下列说法错误的是
A.a极的电极反应式为:2 H+ + 2 e H2 ↑
H2 ↑
B.D口导出的是NaOH溶液
C.浓盐水从A口注入
D.C口导出的是NaOH和NaCl的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.

(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是 。
(2)B装置的作用是 。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
① 停止加热后,再通入N2至整套装置冷却,其目的是 。
② 取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有 。
③ D装置中发生反应的离子方程式是 。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
a.Cu b. CuO c.CuS d.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
酸碱中和反应属于放热反应。当下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是
A. 与NaOH反应时,HCl的中和热小于CH3COOH的中和热
B. 与NaOH反应时,HCl的中和热大于CH3COOH的中和热
C. 与NaOH反应时,H2SO4的中和热大于HCl的中和热
D. 与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡没有发生移动 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时,CO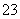 移向电池的 (填“正”或“负”)极。
移向电池的 (填“正”或“负”)极。
 (2)现用氢氧燃料电池进行下图所示实验:
(2)现用氢氧燃料电池进行下图所示实验:
①请写出氢氧燃料电池中的电极反应式:
负极: 正极:
②右图装置中,某一铜电极的质量减轻了3.2 g,则a极上消耗的O2在标准状况下体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Cu—Zn原电池的说法正确的是
A.在原电池中,电子流出的一极为负极
B.原电池中,发生还原反应的电极是负极
C.原电池中,电流的方向是从负极到正极
D.在Cu—Zn原电池中,Cu做负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列检验铵盐的方法中正确的是
A.加热,用湿润的红色石蕊试纸靠近试管口检验
B.加水溶解,用红色石蕊试纸检验溶液的酸碱性
C.加入碱溶液,加热,再滴入酚酞试液
D.加入氢氧化钠溶液加热,用湿润的红色石蕊试纸在试管口检验
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为 ,W与P可形成原子个数比为1∶2的化合物,其电子式为 。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190℃,沸点为180℃,则该化合物为 晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是 (填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为 。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。该反应的化学方程式为 ,若0.6mol X的三氟化物完全反应,则转移的电子总数约为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com