
| A、含2 mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2标准状况下的体积为22.4 L |
| B、78 g Na2O2中所含阴离子的数目是2NA |
| C、2.3g Na和足量的O2完全反应,在常温下燃烧时,转移电子数均为0.1NA |
| D、22.4 L CO和N2的混合气体中含有NA个气体分子 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴离子的配位数:CsCl>NaCl>CaF2 |
| B、热分解温度:BaCO3>CaCO3>MgCO3 |
| C、熔点:NaF>MgF2>AlF3 |
| D、硬度:C3N4>金刚石>碳化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | MgO | AlCl3 | SiCl4 | B(硼) |
| 熔点℃ | 801 | 2852 | 180 | -70 | 2300 |
| 沸点℃ | 1465 | --- | 177 | 57 | 2500 |
| A、晶体的沸点CCl4<SiCl4 |
| B、在火山喷出的岩浆,晶出顺序为MgO先于NaCl |
| C、用AlCl3通过电解法冶炼铝 |
| D、硼的硬度大,不溶于水,但能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用图1所示装置分离沸点相差较大的互溶液体混合物 |
| B、用图2所示装置蒸干FeCl2饱和溶液制备FeCl2晶体 |
| C、用图3所示装置稀释浓硫酸 |
| D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、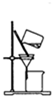 该图装置可以提纯精制氢氧化铁胶体 |
B、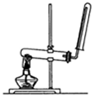 该图装置可以用来制备和收集氨气和氧气 |
C、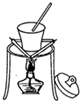 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向氯化铝溶液通入过量的氨气:Al3++4OH-═
| ||||
B、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| C、FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+=Cu2++2Fe2+ | ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com