
分析 (1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液中满足:c(H+)=c(OH-)=1×10-10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液;
(2)在某温度下,H2O的离子积常数为1×10-13 mol2•L-2,则该温度下:100mL 0.1mol•L-1H2SO4溶液和100mL 0.4mol•L-1的KOH溶液混合,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(KOH)=0.4mol/L×0.1L=0.04mol,KOH有剩余,混合溶液中c(OH-)=$\frac{0.04-0.01×2}{0.1+0.1}$mol/L=0.1mol/L,c(H+)=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L;
(3)该溶液可能为中性、酸性、碱性溶液,但溶液中一定满足电荷守恒,根据电荷守恒进行判断;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,根据NH3•H2O的电离常数Kb计算;
(5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3-,则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸.
解答 解:(1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液中满足:c(H+)=c(OH-)=1×10-10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液,溶液的pH可能为4或10,
故答案为:4或10;抑制;
(2)在某温度下,H2O的离子积常数为1×10-13 mol2•L-2,则该温度下:100mL 0.1mol•L-1H2SO4溶液和100mL 0.4mol•L-1的KOH溶液混合,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(KOH)=0.4mol/L×0.1L=0.04mol,KOH有剩余,混合溶液中c(OH-)=$\frac{0.04-0.01×2}{0.1+0.1}$mol/L=0.1mol/L,c(H+)=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12mol/L,pH=12,故答案为:12;
(3)A.当溶液为酸性时,可以满足关系:c(Y-)>c(X+)>c(H+)>c(OH-),故A正确;
B.当溶液呈碱性时可以满足c(X+)>c(Y-)>c(OH-)>c(H+),故B正确;
C.该关系c(H+)>c(Y-)>c(X+)>c(OH-)无法了电荷守恒,故C错误;
D.当溶液呈碱性,且YOH远远过量时可以满足c(OH-)>c(X+)>c(H+)>c(Y-),故D正确;
故答案为:C;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{5×1{0}^{-3}×1{0}^{-7}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
(5)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,根据电离平衡常数知,酸性H2CO3>HClO>HCO3-,则次氯酸钠和二氧化碳水反应生成碳酸氢钠和次氯酸,反应方程式为NaClO+CO2+H2O═HClO+NaHCO3,
故答案为:NaClO+CO2+H2O═HClO+NaHCO3.
点评 本题查离子浓度大小比较、盐类水解的应用及电解原理,为高频考点,题目难度中等,侧重于学生的分析、理解及计算能力的考查,明确盐类水解规律及酸性强弱的关系、电离平衡常数的计算、离子的放电顺序等即可解答,难点是(4)题计算,注意电荷守恒及物料守恒的灵活运用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在16g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| D. | 12gMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
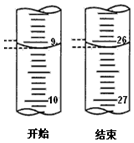 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com