
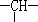 和一个-Cl,则此有机物的结构有( )
和一个-Cl,则此有机物的结构有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 有机物的一氯代物分子中有两个-CH3,两个-CH2-,一个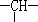 和一个-Cl,则分子式为C5H11Cl,根据戊烷的同分异构体CH3-CH2-CH2-CH2-CH3、
和一个-Cl,则分子式为C5H11Cl,根据戊烷的同分异构体CH3-CH2-CH2-CH2-CH3、 、
、 确定该有机物的结构.
确定该有机物的结构.
解答 解:有机物的一氯代物分子中有两个-CH3,两个-CH2-,一个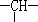 和一个-Cl,则分子式为C5H11Cl,
和一个-Cl,则分子式为C5H11Cl,
若为CH3-CH2-CH2-CH2-CH3,一氯代物有:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;其中CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3符合条件.
若为 ,一氯代物有:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2Cl;CH2ClCH(CH3)CH2CH3符合条件.
,一氯代物有:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;其中CH3CH(CH3)CH2CH2Cl;CH2ClCH(CH3)CH2CH3符合条件.
若为 ,一氯代物:CH3C(CH3)2CH2Cl,不符合条件.
,一氯代物:CH3C(CH3)2CH2Cl,不符合条件.
共4种.
故选B.
点评 本题考查有机物的结构,侧重于同分异构体的考查,为高频考点,有利于培养学生的分析能力,注意把握有机物同分异构体的判断方法,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 158 | C. | 258 | D. | 101 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
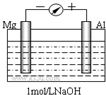 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中的阳离子移向正极 | |
| B. | 负极反应式:CH3OH+8OH--6e-═C+6H2O | |
| C. | 电池在使用过程中,电解质溶液的c(OH-)不变 | |
| D. | 当外电路通过6 mol电子时,理论上消耗1.5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
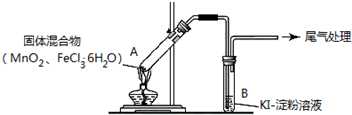
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B 间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B 中KI淀粉溶液替换为NaBr 溶液;检验 Fe 2+ | B中溶液呈浅橙红色;未检出Fe 2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 干冰熔化或升华时,CO2分子内的C=O键会被破坏 | |
| B. | 乙炔与氢气反应会变成乙烯,碳原子的杂化类型由sp变为sp2 | |
| C. | 物质的状态变化,只需克服分子间作用力 | |
| D. | 分子中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
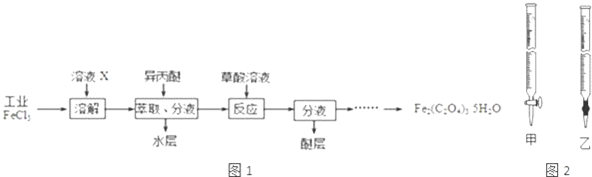
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com