
分析 (1)已知:①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知①+②得C(s)+H2O(g)?CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应(i)△S>0,结合△H-T△S<0判断;
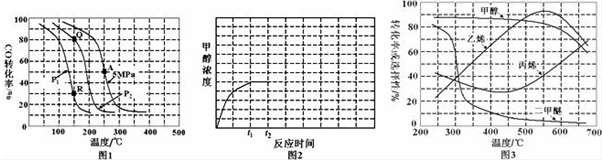
(2)①A点CO的转化率为0.5,假设加入1molCO、2molH2,则
CO(g)+2H2(g)?CH3OH(g)
初始:1mol 2mol 0
转化:0.5mol 1mol 0.5mol
平衡:0.5mol 1mol 0.5mol
p(CO)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
p(H2)=5MPa×$\frac{1mol}{0.5mol+1mol+0.5mol}$=2.5MPa,
p(CH3OH)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
结合平衡时p计算Kp;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响;
③A点对应的温度为250℃,CO的抓化率为50%,275℃下CO转化率可达到40%左右,说明升高温度,平衡逆向移动;增大压强,平衡正向移动;
④反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变;
(3)为尽可能多地获得乙烯,要综合考虑甲醇的平衡转化率和乙烯的物质的量分数.
解答 解:(1)已知:①C(s)+CO2(g)═2CO(g)△H=+172.5kJ•mol-1,
②CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1,
根据盖斯定律可知①+②得C(s)+H2O(g)?CO(g)+H2(g)△H=+172.5kJ•mol-1-41.0kJ•mol-1=+131.5kJ•mol-1>0,反应(i)△S>0,高温时G=△H-T△S<0反应自发,
故答案为:高温;
(2)①A点CO的转化率为0.5,假设加入1molCO、2molH2,则
CO(g)+2H2(g)?CH3OH(g)
初始:1mol 2mol 0
转化:0.5mol 1mol 0.5mol
平衡:0.5mol 1mol 0.5mol
p(CO)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
p(H2)=5MPa×$\frac{1mol}{0.5mol+1mol+0.5mol}$=2.5MPa,
p(CH3OH)=5MPa×$\frac{0.5mol}{0.5mol+1mol+0.5mol}$=0.75MPa,
Kp=$\frac{p(C{H}_{3}OH)}{p(CO){p}^{2}({H}_{2})}$=$\frac{0.75}{0.75×(2.5)^{2}}$=0.16,
故答案为:0.16;
②150℃时,Q点比R点对应的CO的转化率大,平衡正向移动CO的转化率增大,而压强增大,CO(g)+2H2(g)?CH3OH(g)的平衡正向移动,说明P1>P2;Kp只受温度的影响,Q点和R点对应的温度都是150℃,因此Kp(Q)=Kp(R),
故答案为:小于;等于;
③A点对应的温度为250℃,CO的抓化率为50%,275℃下CO转化率可达到40%左右,说明升高温度,平衡逆向移动,CO(g)+2H2(g)
故答案为:升高温度;增大压强;
④反应(ii)CO(g)+2H2(g)?CH3OH(g)△H<0,t2时降低温度,平衡正向移动,甲醇的浓度增大,直至t3时达到新的平衡时保持不变,对应的图象为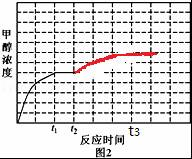 ,故答案为:
,故答案为: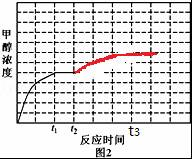 ;
;
(3)为尽可能多地获得乙烯,要综合考虑甲醇的平衡转化率和乙烯的物质的量分数,550℃时甲醇的平衡转化率仍处于较高水平,而且此温度下产物中乙烯的物质的量分数最大,
故答案为:550℃时甲醇的平衡转化率仍处于较高水平且产物中乙烯的物质的量分数最大.
点评 本题考查化学平衡的计算及浓度与时间曲线,为高频考点,把握平衡移动影响因素、平衡计算、盖斯定律及反应方向判断为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
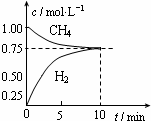 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
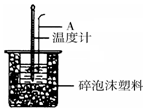 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| C. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com