
【题目】对图中的表述中正确的是( )
A.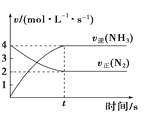 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.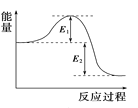 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.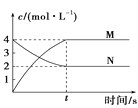 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
科目:高中化学 来源: 题型:
【题目】(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
体系压强(Pa) | p1 | p2 | p3 | |
反应的能量变化 | akJ | bkJ | ckJ | |
原料转化率 | α1 | α2 | α3 | |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3C.|a|+|b|=90.8 D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
|
|
|
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为
之间的关系为![]() ______;
______;![]() 、
、![]() 、
、![]() 的关系为
的关系为![]() ______。
______。
(2)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、![]() 等有毒气体转化为无毒气体:
等有毒气体转化为无毒气体:![]() 对于该反应,温度不同
对于该反应,温度不同![]() ,其他条件相同时,下列图象正确的是______
,其他条件相同时,下列图象正确的是______![]() 填序号
填序号![]() 。
。

(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() 在
在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 时,该反应在
时,该反应在![]() 的平均反应速率
的平均反应速率![]() ______;该反应的平衡常数
______;该反应的平衡常数![]() ______;
______;
![]() 后只改变某一条件,根据上表数据判断改变的条件可能是______
后只改变某一条件,根据上表数据判断改变的条件可能是______![]() 填序号
填序号![]() ;
;
A.加入一定量的活性炭 ![]() 恒温恒压充入氩气
恒温恒压充入氩气
C.适当缩小容器的体积 ![]() 加入合适的催化剂
加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。

请回答:
(1)该同学用镊子夹取湿润的红色石蕊试纸靠近试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈___性。
(2)收集氨气时,请你选择氨气的进气口___(“a”或“b”)。
(3)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是___。
(4)以下装置(盛放的液体均为水)可用于吸收多余氨气的是___(填序号)。
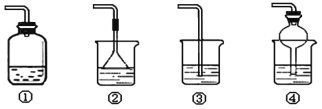
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小时候很想知道天天喝的水究竟由啥构成?到了初中又想查查这瓶纯净水(蒸馏水,体积360mL,密度1g/cm3)中有多少个水分子呢?学了“物质的量”这个能在宏观物质和微观粒子之间架起“桥梁”的物理量,实现这个愿望太简单了。请填空:
这瓶纯净水的质量为______ g,含有水分子______个,含有原子总数_____NA个(NA表示阿伏伽德罗常数),若把这些水变成水蒸气再换算到标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
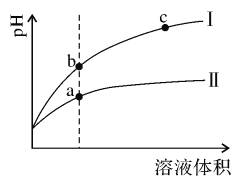
①稀释醋酸时pH值变化曲线是:___________(填:“I”或“Ⅱ”),
②b点溶液的导电性比c点溶液的导电性:___________(填:“强”、“弱”或“无法比较”),
③a、c两点Kw的数值相比,a___________c(填:“大于”、“小于”或“等于”),
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:___________(用离子方程式表示)。
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)___________0.1mol/L NH4HSO4溶液中c(NH4+)(填“大于”、等于”或“小于”)。
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图像,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是____ (填字母)。导致溶液pH随温度变化的原因是:_________________________________。
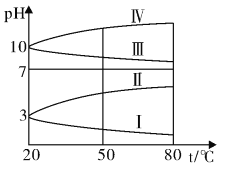
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。请回答下列问题:
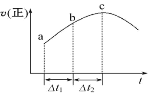
①a~c段反应速率增大的原因是____________。
②有关该反应的说法正确的是________(填字母)。
a.若容器内温度保持不变,可以说明反应达到了平衡状态
b.反应物浓度:a点小于b点
c.反应在c点达到平衡状态
d.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
e.若容器内气体的平均摩尔质量保持不变,可以说明反应达到了平衡状态
(2)利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示。此装置既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。请回答下列问题:
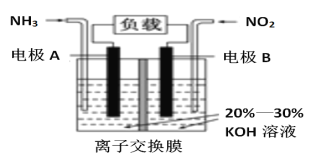
①B电极为______(填“正”或“负”)。
②当有4.48 L NH3(标准状况)参加反应时,转移电子数为________。
③电极A极反应式为______。
④为使电池持续放电,离子交换膜最好选用__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是________(填字母代号)。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极通入的气体为_______(填化学式);负极的电板反应式为_______。
(3)电解原理在化学工业中有着广泛的应用。如图所示的电解池中,a为滴加了少量酚酞的NaCl溶液,X和Y是两块惰性电极板,则电解时,________(填“X”或“Y”)极附近的溶液变红,电解的离子方程式为_______。
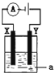
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com