
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大,主要原因是增加了反应物分子浓度 | |
| D. | 使用正催化剂能增大活化分子百分数,从而显著地增大化学反应速率 |
分析 A.增大反应物浓度,增大单位体积内活化分子个数;
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子的个数;
C.升高温度,增大活化分子百分数;
D.加入正催化剂能增大活化分子百分数.
解答 解:A.增大反应物浓度,增大单位体积内活化分子个数,但活化分子百分数不变,故A错误;
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子的个数,但活化分子百分数不变,故B错误;
C.升高温度,使部分非活化分子转化为活化分子,所以增大活化分子百分数,反应速率增大,故C错误;
D.加入正催化剂,降低活化分子所需活化能,所以能增大活化分子百分数,反应速率加快,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率影响原理是解本题关键,注意基础知识点的总结和归纳,注意温度、浓度、催化剂、压强对反应速率影响的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
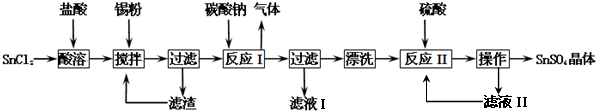
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
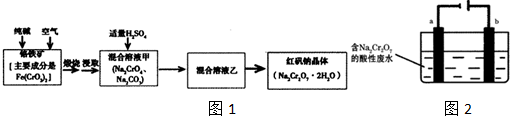
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯.BPA的结构简式如图所示.
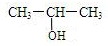 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2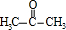 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,⑤的电子式是
,⑤的电子式是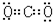 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$ 3O2 | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| C. | 3C12+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com