
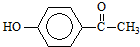
 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )| A. | 能跟氢氧化钠反应 | |
| B. | 能跟浓溴水反应 | |
| C. | 能跟碳酸氢钠反应 | |
| D. | 在催化剂存在时能被还原成含醇羟基的物质 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 min | B. | 27 min | C. | 13.5 min | D. | 3 min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 稀硝酸和过量的铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 少量SO2气体通入NaOH溶液中:SO2+OH-=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
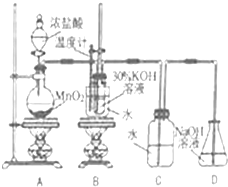 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.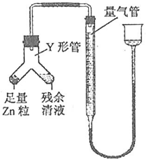 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液和过量的NaOH溶液反应:Al3++4OH-=AlO2-+2H2O | |
| B. | Mg(OH)2与盐酸的反应:H++OH-═H2O | |
| C. | 硫化亚铁(FeS)与盐酸反应:S2-+2H+═H2S↑ | |
| D. | 钠和冷水反应:Na+2H2O═Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28g乙烯所含共用电子对数目为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com