
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
分析 A、Cl2与足量的NaOH溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O,氧化剂还原剂都是氯气;
B、0.1molZn与含0.1molHCl的盐酸充分反应,盐酸全反应,金属锌剩余;
C、1molNa与足量O2反应,金属钠全部转化为+1价的钠离子,据此计算转移的电子数;
D、向FeI2溶液中通入适量Cl2,先将碘离子氧化,然后将亚铁离子氧化.
解答 解:A、Cl2与足量的NaOH溶液反应:Cl2+2NaOH=NaClO+NaCl+H2O,1mol Cl2与足量的NaOH溶液反应,转移的电子数为NA,故A错误;
B、0.1molZn与含0.1molHCl的盐酸充分反应,盐酸全反应,金属锌剩余,转移的电子数目为0.1NA,故B错误;
C、1molNa与足量O2反应,金属钠全部转化为+1价的钠离子,转移的电子数为NA,故C正确;
D、向FeI2溶液中通入适量Cl2,先将碘离子氧化,然后将亚铁离子氧化,当有1molFe2+被氧化时,共转移的电子的数目大于NA,故D错误.
故选C.
点评 本题考查了氧化还原反应中电子转移以及阿伏伽德罗常数的有关计算知识,熟练掌握公式的使用和基本概念是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
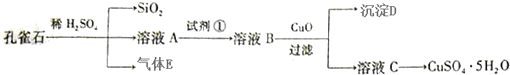
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯| A. | ①⑥⑦ | B. | ①③④⑥ | C. | ①④⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
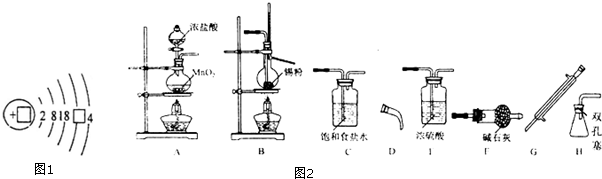
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
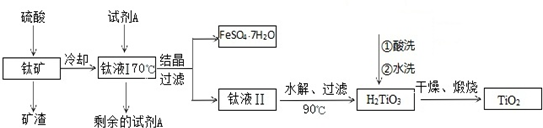
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
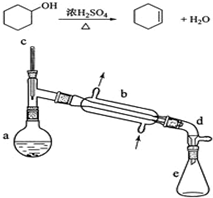 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com