
【题目】高锰酸钾是实验室常用的氧化剂。某实验小组制备高锰酸钾,具体流程如图:
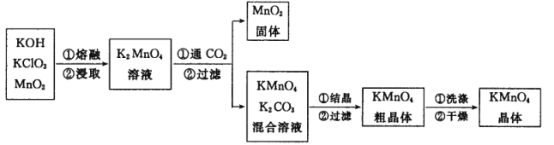
实验一:锰酸钾的制备。称取3.0 g KClO3固体和 7. 0 g KOH固体混合,于铁坩埚中小火加热,待混合物熔融后用铁棒不断搅拌,再加入4.0g MnO2 继续加热。
(1)熔融时加人 MnO2 后坩埚中反应的化学方程式为 _____________。
(2)用铁棒而不用玻璃棒搅拌的原因是______________ 。
实验二:锰酸钾的歧化。待铁坩埚冷凉后放人烧杯中,加水共煮浸取,取出坩埚,开启启普发生器,趁热向溶液中通入CO2,直到溶液绿色全部变为紫色为止,静置沉淀,用砂芯漏斗进行抽滤,留滤液。歧化反应实验装置如图所示:
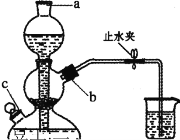
(3)向启普发生器中加入块状固体的位置_______ (选填字母“a”“b”或“ c”)。该仪器的优点是方便控制反应的发生与停止,其原理是_____________。
(4)烧杯中锰酸钾歧化反应的化学方程式为___________________。
(5)锰酸钾歧化时不能用盐酸代替 CO2,原因是_______________ 。
实验三:锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,蒸发浓缩,自然冷却结晶,抽滤至干。将晶体转移至已知质量的表面皿上,放入烘箱中 80℃ 干燥半小时左右,冷却,称量,产品质量为 3.16 g。
(6)蒸发浓缩滤液至___________停止加热。
(7)该实验小组制备高锰酸钾的产率是____________。
【答案】KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O 玻璃棒中的SiO2在熔融状态下与KOH反应 b 打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止。 3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3 锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率 溶液表面出现晶膜时 65.25%
3K2MnO4+KCl+3H2O 玻璃棒中的SiO2在熔融状态下与KOH反应 b 打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止。 3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3 锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率 溶液表面出现晶膜时 65.25%
【解析】
(1)根据氧化还原反应分析化学方程式;
(2)玻璃棒的成分为SiO2;
(3)根据启普发生器原理分析;
(4)根据氧化还原反应分析化学方程式;
(5)锰酸钾具有强氧化性,与HCl反应;
(6)根据蒸发结晶的操作作答;
(7)根据质量守恒关系式计算产率。
(1)根据信息,反应方程式为:MnO2+KClO3+KOH→K2MnO4+KCl,MnO2→K2MnO4化合价↑2,KClO3→KCl化合价↓6,最小公倍数为6,因此MnO2、K2MnO4的系数为3,根据钾元素守恒,KOH的系数为6,根据原子守恒,配平其他,则KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O,故答案为:KClO3+3MnO2+6KOH
3K2MnO4+KCl+3H2O,故答案为:KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O;
3K2MnO4+KCl+3H2O;
(2)玻璃的成分中含SiO2,因为SiO2属于酸性氧化物,可以和KOH反应,因此不能用玻璃仪器,而用铁坩埚和铁制搅拌棒,故答案为:玻璃棒中的SiO2在熔融状态下与KOH反应;
(3)固体放在启普发生器的中间层,从b处加入块状固体;打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止,故答案为:b;打开止水夹,块状固体与液体接触发生反应,关闭止水夹,启普发生器内压强增大,液体被压入长颈漏斗,块状固体和液体脱离接触,反应停止;
(4) MnO42-→MnO4-+MnO2,MnO42-→MnO4-化合价↑1,MnO42-→MnO2化合价↓2,最小公倍数为2,即MnO4-的系数为2,则MnO42-的系数为3,根据反应前后原子守恒和所带电荷守恒,CO2转化成了CO32-,因此化学反应方程式为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3,故答案为:3K2MnO4+2CO2=MnO2+2KMnO4+2K2CO3;
(5)锰酸钾具有强氧化性,与HCl反应生成氯气,造成污染,同时也降低高锰酸钾的产率,故答案为:锰酸钾可以将盐酸氧化放出氯气造成污染,同时也降低高锰酸钾的产率;
(6)蒸发浓缩滤液至溶液表面出现晶膜时停止加热,故答案为:溶液表面出现晶膜时;
(7)由(1)有KClO3+3MnO2+6KOH![]() 3K2MnO4+KCl+3H2O,加入4.0g MnO2消耗的KClO3的质量为1.88g,消耗的KOH的质量为5.15g,可知MnO2完全反应,再结合3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3,则有关系式
3K2MnO4+KCl+3H2O,加入4.0g MnO2消耗的KClO3的质量为1.88g,消耗的KOH的质量为5.15g,可知MnO2完全反应,再结合3K2MnO4 +2CO2=MnO2+2KMnO4+2K2CO3,则有关系式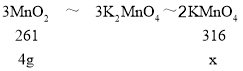 ,则理论上生成的高锰酸钾质量x=
,则理论上生成的高锰酸钾质量x=![]() ,高锰酸钾的产率是
,高锰酸钾的产率是![]() ,故答案为:65.25%。
,故答案为:65.25%。


科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是( )

A.在0~a范围内,只发生H++OH-=H2O
B.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C.a=0.2
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
A.上述过程中,最终被还原的是NO3-
B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述过程中,会产生一种无色的难溶于水的气体
D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2
【答案】B
【解析】
A.SO2通入硝酸铁稀溶液中,溶液由棕黄色变为浅绿色,是因为Fe3+与SO2发生氧化还原反应生成SO42-、Fe2+;溶液立即又变为棕黄色,是因为Fe2+与NO3-、H+发生氧化还原反应生成Fe3+,所以最终被还原的是NO3-,故A正确;
B.SO2能够被Fe3+氧化成H2SO4,Fe2+能够被稀硝酸氧化成Fe3+,则氧化性:稀硝酸>Fe3+>稀硫酸,故B错误;
C.稀溶液中,NO3-在酸性环境中被还原为NO,NO是无色的难溶于水的气体,故C正确;
D.上述过程中,最终被还原的是NO3-,故整个过程相当于SO2和NO3-之间发生了氧化还原反应,由关系式3SO2~2NO3-可知,SO2与NO的体积比为3∶2,故D正确;
故答案为B。
【题型】单选题
【结束】
14
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 9 月,我国科研人员研制出 Ti-H-Fe 双温区催化剂,其中 Ti-H 区域和Fe 区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是
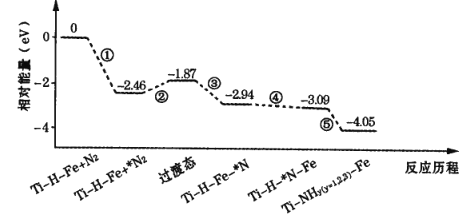
A.①②③在 Fe 区域发生,④⑤在Ti-H区域发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2. 46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti-H-Fe 双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
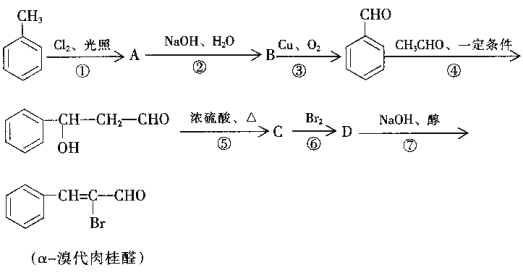
(1)反应①的类型是__________________,反应⑥的类型是____________________。
(2)C的结构简式是___________________,D的结构简式是___________。
(3)写出反应②的化学方程式:_________________________________________。
(4)反应⑦中,除生成α-溴代肉桂醛的同时,是否还有可能生成其他有机物?若有,请写出其结构简式:_______________________________。(只写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
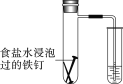
①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
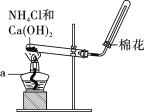
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。
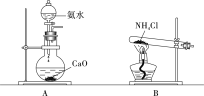
(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
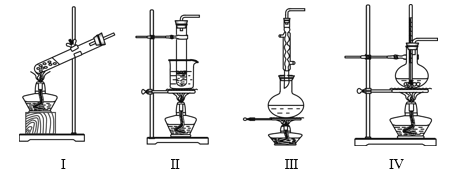
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com