
 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破.用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破.用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:分析 (1)Cu位于第四周期ⅤⅡB族,是29号元素,基态铜原子的价电子排布式为1s22s22p63s23p63d104s1;同主族元素第一电离能自上而下逐渐减小;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,且含有一个孤电子对,所以其空间构型是V型,S原子采用sp2杂化;
(3)硫酸铜溶液与氨水生成氢氧化铜,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子;
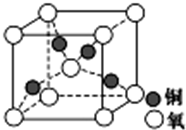
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,由均摊法计算氧化亚铜晶胞中Cu原子和O原子的数目,根据密度计算公式ρ=$\frac{m}{ρ}$计算出体积,再计算铜原子与氧原子之间的距离即可.
解答 解:(1)Cu位于第四周期ⅤⅡB族,是29号元素,基态铜原子的价电子排布式为3d104s1;同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧;
故答案为:3d104s1;O;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V型;与二氧化硫互为等电子体的有O3;
故答案为:sp2;V型;O3;
(3)硫酸铜溶液与氨水生成氢氧化铜蓝色沉淀,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,蓝色沉淀溶于氨水的离子方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有共价键、配位键,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,在铜的某种氧化物晶胞中,O原子在晶胞的顶点和体心,故O原子数=$\frac{1}{8}$×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=$\frac{m}{V}$可知,体积V=$\frac{m}{ρ}$=$\frac{\frac{288}{{N}_{A}}}{d}$=$\frac{288}{d{N}_{A}}$cm3,所以晶胞的边长为$\root{3}{\frac{288}{d{N}_{A}}}$cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的$\frac{\sqrt{3}}{4}$,所以该晶胞中铜原子与氧原子之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{288}{d{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{288}{d{N}_{A}}}$×1010pm,
故答案为:面心立方最密堆积;$\frac{\sqrt{3}}{4}$$\root{3}{\frac{288}{d{N}_{A}}}$×1010.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、配位键、微粒空间构型判断等知识点,侧重考查学生计算及空间想象能力,难点是晶胞计算,注意Cu、O原子之间的距离与棱长的关系,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用水润湿的 pH 试纸测量某溶液的 pH | |
| B. | 用量筒量取 20 mL 0.5000 mol/LH2SO4溶液于烧杯中,加水 80 mL,配制成 0.1000 mol/LH2SO4溶液 | |
| C. | 实验室用图Ⅰ所示装置制取并收集少量氨气 | |
| D. | 实验室用图Ⅱ所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的 | |
| B. | 正常雨水的PH为7 | |
| C. | 生物质能的缺点是严重污染环境 | |
| D. | 煤、石油、沼气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com