
| 实验 序号 |
时间 浓度 温 度(℃) |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| △c |
| △t |
| 0.80mol/L-0.67mol/L |
| 10min |
| 1.0mol/L-0.40mol/L |
| 10min |


科目:高中化学 来源: 题型:
| ||
| TiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| m |
| n |
| m |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
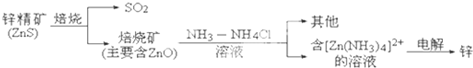
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)+Cl2(g)=2HCl(g);△H=-92.3 kJ/mol |
| B、H2(g)+Cl2(g)=HCl(g);△H=+92.3kJ/mol |
| C、2HCl=H2+Cl2;△H=+184.6kJ/mol |
| D、H2 (g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若保持恒容,充入C气体后混合气体颜色加深,则说明B是有颜色的气体 |
| B、若升高温度,发现C的物质的量减少,则说明正反应为放热反应 |
| C、若压缩容器,平衡不移动,则说明B和D一定都是气体 |
| D、保持恒容,到达平衡后继续充入A会使B的转化率增大,A的转化率减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com