
A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的电子排布图是 ;D元素原子的价电子排布式是 ;
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
(1) (1分);
(1分);  ;3s23p5
;3s23p5
(2)HF>HCl (3)NaClO(1分);ClO-+H2O OH-+HClO (其它每项2分)
OH-+HClO (其它每项2分)
解析试题分析:A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子,则A是氢元素;B元素的基态原子2p轨道上只有一对成对电子,这说明2p轨道上有4个电子,则B元素氧元素;C与B处于同一周期,且原子半径小于B。根据同周期自左向右原子半径逐渐减小可知,C一定是氟元素;D与C是同主族元素,且属于短周期元素,因此D是氯元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构,因此E是钠元素。
(1)氧元素位于周期表的第二周期第ⅥA族,所以其原子结构示意图是 ;F元素的原子序数是9,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,氟原子的电子排布图是
;F元素的原子序数是9,则根据构造原理、能量最低原理、洪特规则以及泡利原理可知,氟原子的电子排布图是 ;氯元素位于第三周期第ⅦA族,所以其原子的价电子排布式是3s23p5。
;氯元素位于第三周期第ⅦA族,所以其原子的价电子排布式是3s23p5。
(2)非金属性越强,氢化物的稳定性越强。同主族自上而下非金属性逐渐减弱,则非金属性强弱顺序是F>Cl 。因此A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是HF>HCl。
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,这说明该化合物的水溶液显碱性,且还具有漂白性,因此该化合物是NaClO;次氯酸钠是强碱弱酸盐,溶于水ClO-水解溶液显碱性,水解方程式为ClO-+H2O OH-+HClO。因此用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因为ClO-+H2O
OH-+HClO。因此用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因为ClO-+H2O OH-+HClO。
OH-+HClO。
考点:考查元素周期表的结构、核外电子排布以及元素周期律的应用与判断


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
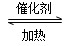 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为 ;用电子式表示乙与戊形成化合物的过程 。
(2)丙、丁、戊的离子半径由大到小的顺序为 ;乙、戊、己的氢化物的还原性最弱的是 。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式 ;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为 。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为 。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为: 。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式: 。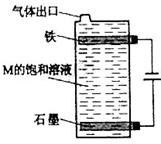
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,其中A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,B、F同主族,且C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,E元素在地壳中的含量仅次于氧,请用化学用语回答下列问题:
(1)写出A、C两种元素组成的化合物的电子式:____________;
(2)B、F的氢化物沸点较高的为____________;
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是 (用离子方程式表示)
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有_______________;
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了_______个氧原子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出元素名称:C 、D 、E 。
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,B的最简单气态氢化物的电子式为____________,BC2分子的结构式是 ______________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是 。 (4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的特征电子构型是 ,在元素周期表中位置是 ,其最高价氧化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
| | | J | | |
| | | | | R |
| | I1 | I2 | I3 | I4 | …… |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为_____________________
(2)上述四种元素的原子半径由大到小的顺序为__________________(用元素符号表示)
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为_____________________
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: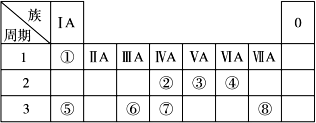
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com