
按要求填空
(1)形状大小相同的铁、铝分别与等浓度的盐酸反应生成氢气的速率:铁______铝(填“大于”、“小于”或“等于”)。
(2)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”)
①升高温度:________;
②增大盐酸浓度:__________;
③增大铁的质量:__________;
④增加盐酸体积:____________;
⑤把铁片改成铁粉:____________;
⑥滴入几滴CuSO4溶液:____________;
⑦加入NaCl固体:____________;
⑧加入CH3COONa固体____________;
⑨加入一定体积的Na2SO4溶液____________。
(3)若把(2)中的稀盐酸改成“稀硝酸”或“浓硫酸”是否还产生H2,为什么?
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度( )
(2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全( )
(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )
(4)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )
(5)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )
(6)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变( )
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
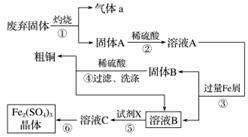
(1)③实验操作中用到的玻璃仪器有________________________________________。
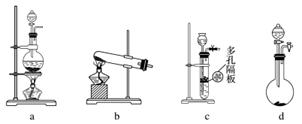
(2)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________(填字母)。
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:__________________。
(4)溶液B加稀硫酸酸化后加强氧化剂X,试剂X最好选择下列哪种试剂______________(填字母)。
a.Cl2 b.H2O2 c.KMnO4
试剂X在酸性条件下与溶液B反应的离子方程式为________________________。
(5)由溶液C经________、________、过滤等操作得Fe2(SO4)3晶体。
(6)某同学用实验制得的Fe2(SO4)3晶体配制0.1 mol·L-1的Fe2(SO4)3溶液,在称量出Fe2(SO4)3晶体后,溶解该晶体的具体操作为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
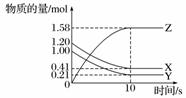
(1)从反应开始到10 s时,v(Z)=________________________________________________。
(2)反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________________。
(3)实验①和②的目的是___________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
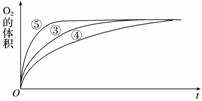
分析上图能够得出的实验结论是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是( )
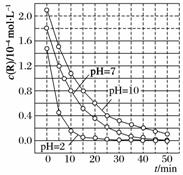
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间, pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题。
(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g)
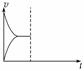
常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2 mol N2,请在右图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
(2)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
| 活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol 时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(3)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0
某科学实验小组将6 mol CO2和8 mol H2充入一容积为 2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
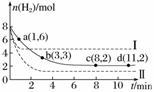
①该反应在0~8 min内CO2的平均反应速率是________ mol·L-1·min-1。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线 Ⅰ 改变的条件可能是________,曲线 Ⅱ 改变的条件可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?________(填“正确”或“不正确”),并说明理由:
________________________________________________________________________。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足什么关系?______________(用等式或不等式表示)。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变________(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”或“否”),并说明原因:_____________________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com