
 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
| 0.5mol |
| 1mol |
| 2mol-1mol |
| 2mol |
| c(C) |
| c(A)?c(B) |
| 0.5mol?L -1 |
| 0.5mol?L -1?0.5mol?L -1 |
| ||||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
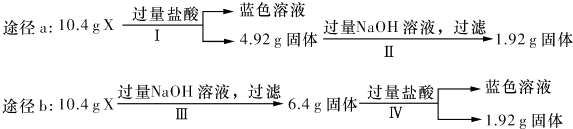
| A、由工可知X中一定存在Fe2 O3、Cu |
| B、无法判断混合物中是否含有Al2O3 |
| C、1.92 g固体成分为Cu |
| D、原混合物中m( Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
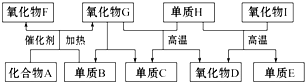
查看答案和解析>>
科目:高中化学 来源: 题型:
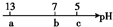 常温下,向10mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a、b、c三点的pH为实验中所测得.下列有关说法中一定正确的是( )
常温下,向10mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a、b、c三点的pH为实验中所测得.下列有关说法中一定正确的是( )| A、当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO-)>c(Na+) |
| D、继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1 mol?L-1NH4 Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、浓度均为0.1mol?L-l的三种溶液中:①(NH4)2CO3、②(NH4)2 SO4、③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NO3-、I-、H2SO3 |
| B、Na+、Fe3+、NO3-、CO32- |
| C、Al3+、NO3-、SO32-、OH- |
| D、NH4+、Na+、SO42-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com